题目内容
(共10分)甲醇合成反应及其能量变化如图所示:
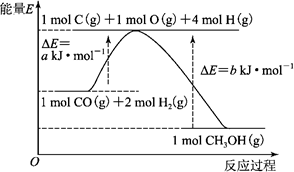
(1)写出合成甲醇的热化学方程式________________________________。
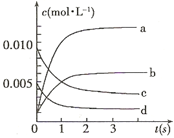
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
(2)在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=________。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。该反应中a的大小对反应热ΔH有无影响,___________________________。

(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。该反应中a的大小对反应热ΔH有无影响,___________________________。
(每空2分,共10分)
(1)CO(g)+2H2(g)=CH3OH(g) ΔH=-(b-a) kJ·mol-1
(2)0.08 mol/(L·min)
(3)25
(4)80%
(5)无影响
(1)CO(g)+2H2(g)=CH3OH(g) ΔH=-(b-a) kJ·mol-1
(2)0.08 mol/(L·min)
(3)25
(4)80%
(5)无影响
(1)根据图像可知,反应物的总能量高于生成物的总能量,因此是放热反应,反应热ΔH=-(b-a) kJ·mol-1,所以热化学方程式是CO(g)+2H2(g)=CH3OH(g) ΔH=-(b-a) kJ·mol-1。
(2)10min时甲醇的浓度是0.4mol/,所以根据化学方程式可知,消耗氢气是0.8mol/L,则氢气的反应速率是0.8mol/L÷10min=0.08 mol/(L·min) 。
(3)在500 ℃达到平衡时,甲醇的物质的量浓度是0.8mol/L,所以消耗CO和氢气分别是0.8mol/L和1.6mol/L,则平衡时氢气和CO的浓度分别是0.4mol/L和0.2mol/L,则该温度下反应的平衡常数是 。
。
(4) CO(g)+2H2(g)=CH3OH(g)
起始量(mol) 1.2 2 0
转化量(mol) x 2x x
平衡量(mol) 1.2-x 2-2x x
则1.2-x+2-2x+x=3.2÷2
解得2x=1.6mol
所以氢气的转化率是2x÷2=0.8,即80%。
(5)反应热只与反应物和生成物能量的相对大小有关系,和其余条件都是无关系的。
(2)10min时甲醇的浓度是0.4mol/,所以根据化学方程式可知,消耗氢气是0.8mol/L,则氢气的反应速率是0.8mol/L÷10min=0.08 mol/(L·min) 。
(3)在500 ℃达到平衡时,甲醇的物质的量浓度是0.8mol/L,所以消耗CO和氢气分别是0.8mol/L和1.6mol/L,则平衡时氢气和CO的浓度分别是0.4mol/L和0.2mol/L,则该温度下反应的平衡常数是
 。
。(4) CO(g)+2H2(g)=CH3OH(g)
起始量(mol) 1.2 2 0
转化量(mol) x 2x x
平衡量(mol) 1.2-x 2-2x x
则1.2-x+2-2x+x=3.2÷2
解得2x=1.6mol
所以氢气的转化率是2x÷2=0.8,即80%。
(5)反应热只与反应物和生成物能量的相对大小有关系,和其余条件都是无关系的。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目

 Y(g)+Z(s),以下能说明反应达到平衡标志的( )
Y(g)+Z(s),以下能说明反应达到平衡标志的( ) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
 2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是
2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是 
 Fe(固)+CO2(气) △H﹤0。已知1100℃时,K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
Fe(固)+CO2(气) △H﹤0。已知1100℃时,K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。 2Z(g)。下列说法中:①X、Y、Z的物质的量之比1:2:2;②混合气体的密度不在改变;③容器中的压强不再发生变化;④单位时间内生成n molZ,同时生成n mol Y上述说法中一定达到化学平衡状态的是
2Z(g)。下列说法中:①X、Y、Z的物质的量之比1:2:2;②混合气体的密度不在改变;③容器中的压强不再发生变化;④单位时间内生成n molZ,同时生成n mol Y上述说法中一定达到化学平衡状态的是 3C(g)+D(g),达到平衡时容器内D的百分含量为a%。若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是( )
3C(g)+D(g),达到平衡时容器内D的百分含量为a%。若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是( ) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: