题目内容
2.(1)设NA为阿伏伽德罗常数,则49g H2SO4含0.5NA个H2SO4分子,能和1molNaOH完全反应,该硫酸所含氢元素的质量与32.67g H3PO4中所含氢元素的质量相同.(2)关注饮用水,保证人民的生活质量.回答下列三个问题:
饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O.请回答下列问题:
①上述反应中的氧化剂为NaNO3.
②用单线桥标出上述反应转移的电子总数和方向
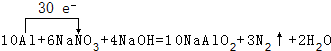 .
.③当转移1mol电子时,标准状况下产生的N2 体积为2.24L.
分析 (1)根据n=$\frac{m}{M}$计算硫酸物质的量,再根据N=nNA计算硫酸分子数目;1mol硫酸能与2molNaOH;氢元素质量相等,则H原子物质的量相等,计算磷酸物质的量,再根据m=nM计算磷酸质量;
(2)①所含元素化合价降低的反应物是氧化剂;
②转移电子数目为30,单线桥中电子转移在反应物中由化合价升高元素指向化合价降低的元素;
③根据电子转移守恒计算生成氮气物质的量,再根据V=nVm计算氮气体积.
解答 解:(1)49g H2SO4物质的量为$\frac{49g}{98g/mol}$=0.5mol,含有H2SO4分子数目为0.5NA;1mol硫酸能与2molNaOH,则与0.5molH2SO4完全反应的NaOH为0.5mol×2=1mol;氢元素质量相等,则H原子物质的量相等,H3PO4的物质的量为$\frac{0.5mol×2}{3}$,磷酸的质量为$\frac{0.5mol×2}{3}$×98g/mol=32.67g,
故答案为:0.5NA;1;32.67;
(2)①反应中N元素化合价由NaNO3中+5价降低为N2中0价,故是氧化剂,故答案为:NaNO3;
②转移电子数目为30,用单线桥标出反应转移的电子总数和方向为: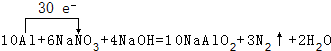 ,
,
故答案为: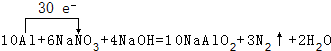 ;
;
③根据电子转移守恒,生成氮气物质的量为$\frac{1mol}{10}$=0.1mol,标准状况下产生的N2 体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24.
点评 本题考查物质的量计算、氧化还原反应,难度不大,注意单线桥与双线桥表示电子转移数目与方向.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
13.下列对于有机物的结构简式、键线式书写错误的是( )
| A. | 丙炔:CH≡C-CH3 | |
| B. | 丙烯:CH2CHCH3 | |
| C. | 2丁烯的结构简式为CH3CH═CHCH3,其键线式为 | |
| D. | 乙醇:CH3CH2OH |
10.下列分离方法中不正确的是( )
| A. | 利用萃取方法用四氯化碳提取溴水中的溴单质 | |
| B. | 利用蒸馏的方法可以分离沸点相差较大的液体混合物 | |
| C. | 利用结晶的方法除去KNO3中的氯化钠 | |
| D. | 利用分液的方法分离酒精和水 |
17.FeSO4•7H2O广泛用于医药和工业领域,实验室制备FeSO4•7H2O的流程如下:
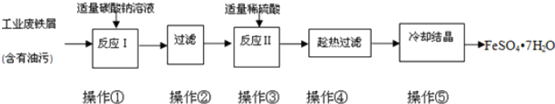
(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是除去废铁屑表面的油污.
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②降低FeSO4在水中的溶解度,减少FeSO4•7H2O的损耗.
(3)FeSO4•7H2O是某些补血剂的主要成分,将1.5g某补血剂预处理,配成100mL溶液.实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5g)中铁元素的含量,
①配制100mL 1.200×10 -2mol•L-1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是c.
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在酸式滴定管中.滴定到终点时的现象为滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色.
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下.
该补血剂中铁元素的质量分数为16.8%.

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是除去废铁屑表面的油污.
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②降低FeSO4在水中的溶解度,减少FeSO4•7H2O的损耗.
(3)FeSO4•7H2O是某些补血剂的主要成分,将1.5g某补血剂预处理,配成100mL溶液.实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5g)中铁元素的含量,
①配制100mL 1.200×10 -2mol•L-1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是c.
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在酸式滴定管中.滴定到终点时的现象为滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色.
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下.
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
7.升高温度,下列数据不一定增大的是( )
| A. | 化学反应速率? | B. | 反应物平衡转化率α | ||
| C. | 水的离子积常数Kw | D. | 盐的水解平衡常数Kh |
14.下列关于工业生产的说法正确的是( )
| A. | 工业生产中催化剂被大量使用是因为催化剂可以提高反应速率和转化率 | |
| B. | 合成氨的工业生产需在高温、高压和催化剂条件下进行是因为该反应是吸热反应 | |
| C. | 合成氨的工业生产中,及时将NH3液化分离出来将有利于提高生成物的产量 | |
| D. | 硫酸的工业生产中,SO2的催化氧化没有采用高压是因为压强对该反应无影响 |
10.设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,
反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3,平衡常数为K3.
请结合表中在不同温度下K1、K2的值,回答下列问题:
(1)反应①的平衡常数表达式K1=$\frac{[CO]}{[C{O}_{2}]}$,△H>0(填“>”、“<”或“=”).
(2)根据反应①与②推导出Q1、Q2、Q3的关系式:Q3=Q3=Q1-Q2.计算出在1173K时反应③的平衡常数K3的数值:K3=1.4.
(3)能判断反应③已达到化学平衡状态的依据是CD.
A.容器中压强不变 B.△H不变 C.v正(H2)=v逆(CO) D.CO的质量分数不变.
反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,
反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3,平衡常数为K3.
请结合表中在不同温度下K1、K2的值,回答下列问题:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.20 | 1.50 |
(2)根据反应①与②推导出Q1、Q2、Q3的关系式:Q3=Q3=Q1-Q2.计算出在1173K时反应③的平衡常数K3的数值:K3=1.4.
(3)能判断反应③已达到化学平衡状态的依据是CD.
A.容器中压强不变 B.△H不变 C.v正(H2)=v逆(CO) D.CO的质量分数不变.