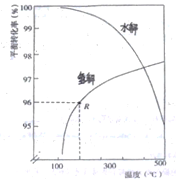
题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
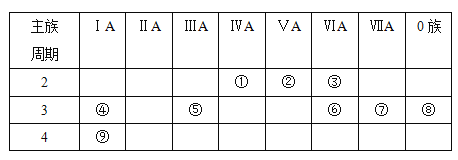
(1)在这些元素中,化学性质最不活泼的是________(填元素符号,下同)。
(2)从①到③的元素中,非金属性最强的是________
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是_________。
(4)最高价氧化物是两性氧化物的元素是_______;写出它的最高价氧化物与氢氧化钠反应的离子方程式_______________________________。
(5)用结构式表示元素①与③形成的一种可溶于水的化合物_________ 。
(6)写出元素④的单质与水反应的化学方程式________________________________。
(7)写出元素①的单质和元素⑥最高价氧化物对应水化物的浓溶液反应的化学方程式___________________________________________。
【答案】 Ar O HClO4 ![]() Al Al2O3+ 2OH﹣=2AlO2﹣+H2O O=C=O 2Na+2H2O=2NaOH+H2↑ C+2H2SO4(浓) =CO2↑+2SO2↑+2H2O
Al Al2O3+ 2OH﹣=2AlO2﹣+H2O O=C=O 2Na+2H2O=2NaOH+H2↑ C+2H2SO4(浓) =CO2↑+2SO2↑+2H2O
【解析】根据元素在周期表中的分布,可以推知①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K。
根据以上分析可知,(1)在这些元素中,化学性质最稳定的是稀有气体Ar;(2)同周期从左到右非金属性减弱,故从①到③的元素中,非金属性最强的是O;(3)根据元素周期律:同周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱可以推知酸性最强的式是HClO4,碱性最强的是KOH,其电子式为![]() ;(4)氢氧化铝是两性氢氧化物,所以最高价氧化物是两性氧化物的元素是Al,它的最高价氧化物与氢氧化钠反应的离子方程式为:Al2O3+ 2OH﹣=2AlO2﹣+H2O;(5)①与③形成的一种可溶于水的化合物为CO2,二氧化碳是碳原子和氧原子间通过极性共价键形成的共价化合物,结构式为:O=C=O;(6)元素④的单质钠与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑;(7)元素①的单质C和元素⑥最高价氧化物对应水化物H2SO4的浓溶液反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓) =CO2↑+2SO2↑+2H2O。
;(4)氢氧化铝是两性氢氧化物,所以最高价氧化物是两性氧化物的元素是Al,它的最高价氧化物与氢氧化钠反应的离子方程式为:Al2O3+ 2OH﹣=2AlO2﹣+H2O;(5)①与③形成的一种可溶于水的化合物为CO2,二氧化碳是碳原子和氧原子间通过极性共价键形成的共价化合物,结构式为:O=C=O;(6)元素④的单质钠与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑;(7)元素①的单质C和元素⑥最高价氧化物对应水化物H2SO4的浓溶液反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓) =CO2↑+2SO2↑+2H2O。

【题目】某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如下图所示:
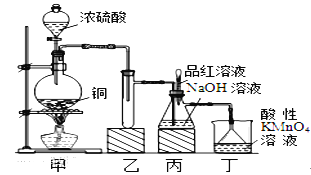
(1)装置甲中发生反应的化学方程式是________________,装置乙的作用是___________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为___________________。
(3)SO2气体有漂白性、还原性和氧化性。将SO2通入溴水中,SO2表现的是__________性,化学反应方程式为_________________________________。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为_____________,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1 mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量1 mol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | (空) |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加__________________。 | 若品红褪色(或有气泡),则说明含有Na2SO3。 |
步骤3:用试管取少量A,向其中加入过量___________。 | 若生成白色沉淀,则说明有NaHSO3生成 |