��Ŀ����
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2SO2��g��+O2��g��2SO3��g����H=��Q kJmol��1��Q��0����ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�������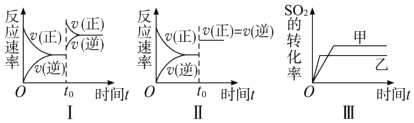
A.ͼ���о�����t0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B.ͼ���о������¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϵ�
C.ͼ���о����Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ�
D.ͼ���о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ��
���𰸡�D
��������A��I��t0ʱ�����淴Ӧ���ʾ���ԭƽ��ʱ��������Ӧ���ʴ����淴Ӧ���ʣ��ı�����ӦΪ����ѹǿ����A���������⣻
B���÷�ӦΪ���ȷ�Ӧ���¶�����ƽ�������ƶ�����Ӧת���ʼ�С����ͼ���о������¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϸߣ���B���������⣻
C��������ƽ���ƶ���Ӱ�죬ͼ��ת���ʷ����仯����ͼ���о������¶ȶԻ�ѧƽ���Ӱ�죬��C���������⣻
D��ͼ�������淴Ӧ����ͬ�ȳ̶ȵ������Ҹ÷�ӦΪ����������ȵķ�Ӧ����ͼ���о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ�죬��D�������⣻
���Դ��ǣ�D��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���ʼ���������Ҫ�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����ܵó���ȷ�𰸣�

����Ŀ��������һ��ǿ������������������������ȡ�
��1��O3��KI��Һ��Ӧ���ɵ����ֵ�����___________��_________�������ʽ����
��2��O3��ˮ���ֽ⣬һ�������£�O3��Ũ�ȼ���һ�������ʱ�䣨t�������ʾ����֪��O3����ʼŨ��Ϊ0.0216 mol/L��
| 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
��pH�����ܼ���O3�ֽ⣬������O3�ֽ�������õ���___________.��
����30��C��pH=4.0�����£�O3�ķֽ�����Ϊ__________ mol/(L��min)��
�۾ݱ��еĵݱ���ɣ��Ʋ�O3�����������·ֽ��������������˳��Ϊ______.������ĸ���ţ�
a. 40��C��pH=3.0 b. 10��C��pH=4.0 c. 30��C��pH=7.0
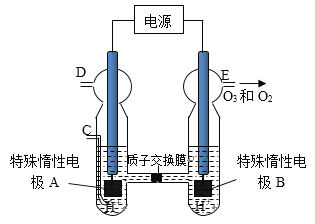
��3��O3 ���ɳ�����������ԭ����ͼ�����ϡ�����Ƶá�
��ͼ������Ϊ_________(�A����B��)����缫��ӦʽΪ_________________.
����C��ͨ��O 2 ����A���ĵ缫��ӦʽΪ_____________________.
����C����ͨ��O 2 ��D��E���ֱ��ռ���xL����yL����(��״��)����E���ռ���������O 3 ��ռ���������Ϊ__________.(����O 3 �ķֽ�)��