题目内容
【题目】用试管收集60mL NO和NO2的混合气体,倒立于盛有水的水槽中,并缓慢通入O2 . 当分别通入VmL或40mL(V<40)O2时,均剩余20mL气体(均为标准状况). ①当通入40mL O2时剩余的气体是
②混合气体中NO2的体积是mL
③V的值是
④当恰好没有气体剩余时,所得溶液的物质的量浓度为(假设溶液不扩散)mol/L(保留到小数点后第三位)
【答案】O2;50;5ml;0.045
【解析】解:①一氧化氮和二氧化氮是一氧化氮的耗氧量大于二氧化氮,所以如果全是一氧化氮需氧气的量为: ![]() =36mL<40mL O2,所以剩余的气体是氧气,所以答案是:O2;
=36mL<40mL O2,所以剩余的气体是氧气,所以答案是:O2;
②设二氧化氮为xml,V(NO2)+3V(NO)=4V(O2)=4×(40﹣20),又因为V(NO2)+V(NO)=60,解之得:V(NO)=10mL,V(NO2)=50mL,所以答案是:50;
③剩余20mL气体是一氧化氮,由反应方程式3NO2+H2O═2HNO3+NO,反应生成一氧化氮的二氧化氮是30ml,所以20mL的二氧化氮与氧气反应,消耗氧气的体积为: ![]() =5mL,
=5mL,
所以答案是:5mL;
④根据c= ![]() =
= 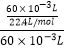 =0.045mol/L,
=0.045mol/L,
所以答案是:0.045.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目


