��Ŀ����
����Ŀ������������գ�
��1���������ʣ����������ƹ��� ��ͭ˿ ���Ȼ������� ��ϡ���� ��CO2����ް�ˮ ��̼�����Ʒ�ĩ �����Ǿ��� �������Ȼ��� ���������ƹ��壮 ���������գ�����״̬���ܵ������ �� ���ڵ���ʵ��� �� ���ڷǵ���ʵ��� �� ������ˮ��������ķ���ʽΪ �� ��̼��������Һ�еμӼ��γ���ʯ��ˮ��������Ӧ�����ӷ���ʽΪ ��
��2���õ����ű������ת�Ƶķ������Ŀ��KClO3+6HCl��Ũ��=KCl+3Cl2��+3H2O �� �÷�Ӧ����������ͻ�ԭ�����������Ϊ �� �����6.72L Cl2����״�������ɣ���Ӧ��ת�Ƶ��ӵĸ���Ϊ
��3������ʯ���̱�ʯ���������Ҫ��ѧ�ɷ�ΪBenAl2Si6O18 �� ������������ʽ��ʾΪnBeOAl2O36SiO2 �� ��nֵΪ���������˽��ơ���������������������Ƴɣ�������ijɷֿɼ�����Ca2Mg5Si8O22��OH��2 �� ���仯ѧʽ��д����������ʽΪ ��
���𰸡�
��1���ڢܢޢ�٢ۢߢ�⣻�ݢࣻ NaHSO4=Na++H++SO42���� Ca2++2OH��+2HCO3��=CaCO3��+2H2O+CO32��
��2��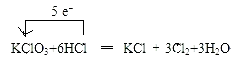 ��5��1��0.5NA
��5��1��0.5NA
��3��3��2CaO?5MgO?8SiO2?H2O
���������⣺��1�����������ƹ��岻�����ɵ��ӻ��������ƶ������ӣ������磬��ˮ��Һ�л�����״̬���ܵ���Ļ�����ǵ���ʣ�
��ͭ˿�������ɵ��ӣ��ܵ��磬�ǵ��ʣ��Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
���Ȼ������岻�����ɵ��ӻ��������ƶ������ӣ������磬��ˮ��Һ���ܵ���Ļ�����ǵ���ʣ�
��ϡ���Ậ�������ƶ������ӣ��ܹ����磬�ǻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
��CO2���岻�����ɵ��ӻ��������ƶ������ӣ������磬�������ܵ���������ƶ������ӣ����ڷǵ���ʣ�
�ް�ˮ���������ƶ������ӣ��ܹ����磬�ǻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
��̼�����Ʒ�ĩ�������ɵ��ӻ��������ƶ������ӣ������磬��ˮ��Һ�л�����״̬���ܵ���Ļ����
�����Ǿ��� �������ɵ��ӻ��������ƶ������ӣ������磬��ˮ��Һ�к�����״̬�²��ܵ���Ļ�������ڷǵ���ʣ�
�������Ȼ��ƺ��������ƶ������ӣ��ܵ��磬��ˮ��Һ�л�����״̬���ܵ���Ļ�����ǵ���ʣ�
���������ƹ��壬�������ɵ��ӻ��������ƶ������ӣ������磬��ˮ��Һ�л�����״̬���ܵ���Ļ�����ǵ���ʣ�
���ԣ�����״̬���ܵ�����Ǣڢܢޢᣬ���ڵ���ʵ��Ǣ٢ۢߢ�⣬���ڷǵ���ʵ��Ǣݢࣻ
��������Ϊǿ����ʣ���ˮ��Һ����ȫ�������������ӡ������ӡ���������ӣ����뷽��ʽ��NaHSO4=Na++H++SO42����
����������������Ӧ����̼���ơ�̼��ƺ�ˮ����Ӧ�����ӷ���ʽ��Ca2++2OH��+2HCO3��=CaCO3��+2H2O+CO32����
���Դ��ǣ��ڢܢޢ�٢ۢߢ�⣻�ݢࣻNaHSO4=Na++H++SO42���� Ca2++2OH��+2HCO3��=CaCO3��+2H2O+CO32������2���÷�Ӧ�У����������Ԫ�صĻ��ϼ���+5�۱�Ϊ0�ۣ��������������������HCl��ClԪ�ػ��ϼ��ɩ�1�����ߵ�0�۱���������Cl2Ϊ��������õ����ű�ʾΪ�� 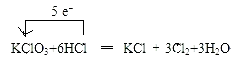 ��
��
���ݷ���ʽKClO3+6HCl��Ũ��=KCl+3Cl2��+3H2O��֪��������Ϊ����أ���ԭ��Ϊ�Ȼ��⣬6mol�Ȼ���μӷ�Ӧ������ԭ�����Ȼ�����5mol�����Ը÷�Ӧ����������ͻ�ԭ�����������Ϊ��5��1��
6.72L Cl2������������ʵ���Ϊ ![]() =0.3mol�����ݷ���ʽ��֪����3mol����ת��5mol���ӣ�������0.3mol����ת�Ƶ�����Ϊ��0.5NA��
=0.3mol�����ݷ���ʽ��֪����3mol����ת��5mol���ӣ�������0.3mol����ת�Ƶ�����Ϊ��0.5NA��
���Դ��ǣ� 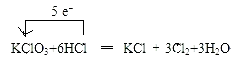 ��5��1�� 0.5NA����3��nBeO��Al2O3��6SiO2������Oԭ���غ�ã�n+3+6��2=18������n=3�����ݹ����θ�д�����������ʽΪ�����ý���������ϻ��ý����������������ˮ��ͬʱҪ��ѭԭ���غ㣬Ca2Mg5Si8O22��OH��2�ɱ�ʾΪ��2CaO5MgO8SiO2H2O��
��5��1�� 0.5NA����3��nBeO��Al2O3��6SiO2������Oԭ���غ�ã�n+3+6��2=18������n=3�����ݹ����θ�д�����������ʽΪ�����ý���������ϻ��ý����������������ˮ��ͬʱҪ��ѭԭ���غ㣬Ca2Mg5Si8O22��OH��2�ɱ�ʾΪ��2CaO5MgO8SiO2H2O��
���Դ��ǣ�3��2CaO5MgO8SiO2H2O��

 ��У����ϵ�д�
��У����ϵ�д�