题目内容
【题目】现有Na2CO3和NaHCO3两种白色固体物质欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:
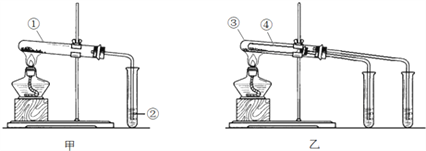
请回答:
(1)如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是______________(填字母).
a.稀HSO4 b.NaOH溶液 c.Ca(OH)2溶液
(2)如乙图所示,试管④中装入的固体应该是_________(填化学式).
(3)通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性_______(填“强”或“弱”).
(4)欲鉴别两种物质的溶液可选用的试剂是________________
(5)等物质的量浓度两种物质的溶液与同浓度的盐酸反应,反应速率快的是_________(填化学式)
(6)除去碳酸钠粉末中混入的碳酸氢钠杂质用______方法,化学方程式_____________________________
(7)除去碳酸氢钠溶液中混入的硅酸钠杂质的试剂是______,所采用的分离方法______
【答案】 c NaHCO3 强 CaCl2溶液 NaHCO3 加热 2NaHCO3![]() Na2CO3+H2O+CO2↑ CO2 过滤
Na2CO3+H2O+CO2↑ CO2 过滤
【解析】(1)碳酸氢钠加热分解生成二氧化碳,二氧化碳使石灰水变浑浊,碳酸钠加热不分解,则甲图分别用Na2CO3和NaHCO3做实验,试管②中的试剂是c,溶液变浑浊可说明,故答案为:c;
(2)碳酸氢钠加热分解,为体现对比,小试管中应为碳酸氢钠,即乙图的试管④中装入的固体应该是NaHCO3,故答案为:NaHCO3;
(3)由上述实验可知,Na2CO3比NaHCO3的稳定性强,故答案为:强;
(4)碳酸钠与氯化钙或氯化钡反应生成白色沉淀,而碳酸氢钠不能,则鉴别两种固体物质可选用的试剂是CaCl2(或BaCl2)溶液,故答案为:CaCl2(或BaCl2)溶液;
(5)碳酸钠与盐酸反应先不生成气体,而碳酸氢钠与盐酸反应直接生成气体,则等物质的量浓度与同浓度盐酸反应速率快的为NaHCO3,故答案为:NaHCO3;
(6)碳酸氢钠不稳定,除去碳酸钠粉末中混入的碳酸氢钠杂质可以用加热的方法,化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:加热;2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:加热;2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(7)除去碳酸氢钠溶液中混入的硅酸钠杂质可以向溶液中通入二氧化碳后过滤,故答案为:CO2;过滤。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | Na2CO3 | 稀盐酸 |
③ | CO2 | Na2O2 | H2O |
④ | FeCl3溶液 | Cu | 稀硫酸 |
A. ①③B. ①④C. ②④D. ②③
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大X浓度使平衡向生成Z的方向移动,X体积分数减小
D. 改变温度可以改变此反应的平衡常数
