题目内容
【题目】(1)基态Fe2+离子有______个未成对电子,基态Ni原子的电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 熔点 | 酸性 |
Si_____S | NaCl______Si | H2SO4_____HClO4 |
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_______。其中氧原子的杂化方式为_____。
(4)与H2O互为等电子体的一种阳离子为________(填化学式);
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有______molσ键。
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是________(用离子方程式表示)。已知AlF63+溶液中可稳定存在。
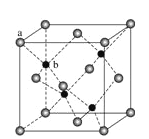
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为_______(列式并计算),a位置S2-离子与b位置Zn2+离子之问的距离为_____pm(列式表示)
【答案】 4 [Ar]3d84s2 < < < V形 sp3 H2F+ 8 3CaF2+Al3+=3Ca2++AlF63- 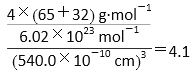
 或
或![]()
【解析】(1)铁的原子序数是26,亚铁离子的核外电子排布式为1s22s2p63s23p63d6,因此基态Fe2+离子有4个未成对电子,Ni的原子序数是28,则基态Ni原子的电子排布式为[Ar]3d84s2。(2)同周期自左向右第一电离能逐渐增大,则第一电离能Si<S;氯化钠是离子晶体,硅是原子晶体,则熔点NaCl<Si;氯元素的非金属性强于硫元素,非金属性越强,最高价含氧酸的酸性越强,则酸性:H2SO4<HClO4。(3)OF2分子中中心原子的价层电子对数是![]() ,含有2对孤对电子,所以构型为V形,其中氧原子的杂化方式为sp3。(4)原子数和价电子数分别都相等的是等电子体,则与H2O互为等电子体的一种阳离子为 H2F+;(5)该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键;(6)由于AlF63+溶液中可稳定存在,因此可以发生反应3CaF2+Al3+=3Ca2++AlF63-,因此CaF2难溶于水,但可溶于含A13+的溶液中。(7)晶胞中含有白色球位于顶点和面心,共含有8×1/8+6×1/2=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为
,含有2对孤对电子,所以构型为V形,其中氧原子的杂化方式为sp3。(4)原子数和价电子数分别都相等的是等电子体,则与H2O互为等电子体的一种阳离子为 H2F+;(5)该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键;(6)由于AlF63+溶液中可稳定存在,因此可以发生反应3CaF2+Al3+=3Ca2++AlF63-,因此CaF2难溶于水,但可溶于含A13+的溶液中。(7)晶胞中含有白色球位于顶点和面心,共含有8×1/8+6×1/2=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为 ;b位置黑色球与周围4个白色球构成正四面体结构,a位置白色球与黑色球b的连线处于晶胞体对角线上,其距离为晶胞体对角线长度的1/4,而体对角线长度为晶胞棱长的
;b位置黑色球与周围4个白色球构成正四面体结构,a位置白色球与黑色球b的连线处于晶胞体对角线上,其距离为晶胞体对角线长度的1/4,而体对角线长度为晶胞棱长的![]() 倍,故a位置S2-离子与b位置Zn2+离子之间的距离为
倍,故a位置S2-离子与b位置Zn2+离子之间的距离为![]() 。
。