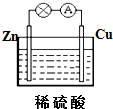
题目内容
2.某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.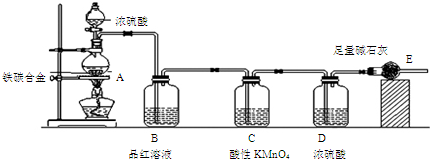
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是常温下碳与浓硫酸不反应、常温下Fe遇浓硫酸发生钝化.
(2)A中铁与浓硫酸在加热时反应的化学方程式为2Fe+6H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O.
(3)待A中不再逸出气体时,停止加热,拆下装置E并称重,装置E增重n g.则铁碳合金中铁的质量分数为$\frac{11m-3n}{11m}$×100%(用含m、n的表达式表示).
(4)甲同学认为利用此装置测得铁的质量分数可能偏小,请写出其可能原因:装置E可吸收空气中的CO2和水蒸气,导致E质量增重偏大.乙同学认为利用此装置测得铁的质量分数可能偏大,请写出其可能原因:装置内残留CO2未被E吸收,导致E质量增重偏小.
分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)铁与浓硫酸在加热的条件下生成二氧化硫、硫酸铁、水;
(3)E增重ng为二氧化碳的质量,根据碳元素守恒计算合金中碳元素的质量,合金的质量减去碳元素质量等于铁的质量,再根据质量分数定义计算;
(4)装置E可吸收空气中的CO2和水蒸气,导致E质量增重;装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小.
解答 解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下碳与浓硫酸不反应,常温下Fe遇浓硫酸发生钝化;
(2)铁与浓硫酸在加热的条件下生成二氧化硫、硫酸铁、水,反应方程式为2Fe+6H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2Fe+6H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O;
(3)E增重n g为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为 $\frac{12}{44}$ng,合金中铁的质量为mg-$\frac{12}{44}$ng=(m-$\frac{3}{11}$n)g,故铁的质量分数 $\frac{m-\frac{3}{11}n}{m}$×100%=$\frac{11m-3n}{11m}$×100%,
故答案为:$\frac{11m-3n}{11m}$×100%;
(4)甲同学认为利用此装置测得铁的质量分数可能偏小,装置E可吸收空气中的CO2和水蒸气,导致E质量增重偏大;
乙同学认为利用此装置测得铁的质量分数可能偏大,装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,质量分数增大,
故答案为:装置E可吸收空气中的CO2和水蒸气,导致E质量增重偏大;装置内残留CO2未被E吸收,导致E质量增重偏小.
点评 本题考查学生对实验原理的理解、对实验方案与实验装置的评价、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,题目难度中等.

| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
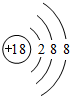 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)④元素与⑦元素形成化合物的电子式
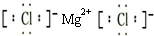 ;
;(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
| A. | K2S | B. | CO2 | C. | NaOH | D. | SiO2 |
| A. | 升温 | B. | 使用合适的催化剂 | ||
| C. | 增大压强 | D. | 增大H2O(g)的浓度 |
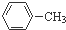 的一氯代物有4种,则甲苯与H2完全加成后的产物的一氯代物应有种类是( )
的一氯代物有4种,则甲苯与H2完全加成后的产物的一氯代物应有种类是( )| A. | 2种 | B. | 4种 | C. | 5种 | D. | 7种 |
①CH3CH2OH+HBr→CH3CH2Br+H2O
②CH4+2O2→CO2+2H2O
③CH3CH3+2Cl2$\stackrel{光照}{→}$CH2ClCH2Cl+2HCl
④
 +HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$
+HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$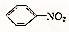 +H2O.
+H2O.| A. | 仅③ | B. | 仅①③ | C. | 仅①③④ | D. | 全部 |
①加热时放出的气体可以使品红溶液褪色 ②加碱调至碱性后,加热时放出的气体可以使湿润的红色
石蕊试纸变蓝 ③加入数滴氯水时,溶液无色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在溶液中是否存在的是( )
| A. | Br- | B. | SO42- | C. | H2SO3 | D. | NH4+ |
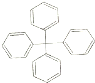
| A. | 分子式为C25H20 | |
| B. | 分子中所有原子有可能处于同一平面 | |
| C. | 该有机物不饱和度为16 | |
| D. | 该物质不属于苯的同系物 |