题目内容
已知A、B、C、X、Y、Z、W为短周期的七种元素,且原子序数依次增大。A的原子半径最小,B是形成化合物种类最多的元素,C元素最外层电子数是次外层电子数的3倍,Z和C同主族;X、Y、W三元素原子的最外层共有11个电子,且三元素的最高价氧化物对应水化物之间两两皆能反应,均能生成盐和水。请回答下列问题:
(1)写出Z元素的原子结构示意图_________________,该元素位于周期表的第______周期,___________族;
(2)写出BC2的电子式____________________,W最高价氧化物对应水化物的化学式___________________________;
(3)写出BC2和X2C2反应的化学方程式_______________________________________;
(4)写出X、Y元素的最高价氧化物对应水化物之间相互反应的离子方程式____________
________________________________________________;
(5)化合物BA4的空间结构是________________________
写出BA4在空气中完全燃烧的化学方程式____________________________________
(6)周期表中与W上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(1)写出Z元素的原子结构示意图_________________,该元素位于周期表的第______周期,___________族;
(2)写出BC2的电子式____________________,W最高价氧化物对应水化物的化学式___________________________;
(3)写出BC2和X2C2反应的化学方程式_______________________________________;
(4)写出X、Y元素的最高价氧化物对应水化物之间相互反应的离子方程式____________
________________________________________________;
(5)化合物BA4的空间结构是________________________
写出BA4在空气中完全燃烧的化学方程式____________________________________
(6)周期表中与W上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(15分)(1)(每空1分)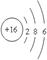 ;3;ⅥA
;3;ⅥA
(2)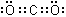 (2分);HClO4(1分)(3)2CO2+2Na2O2=2Na2CO3+O2 (2分)
(2分);HClO4(1分)(3)2CO2+2Na2O2=2Na2CO3+O2 (2分)
(4)Al(OH)3+OH-=AlO2-+H2O (2分)
(5)正四面体 CH4+2O2 CO2+2H2O (3分)
CO2+2H2O (3分)
(6) HF HF分子之间存在氢键 (2分)
 ;3;ⅥA
;3;ⅥA (2)
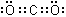 (2分);HClO4(1分)(3)2CO2+2Na2O2=2Na2CO3+O2 (2分)
(2分);HClO4(1分)(3)2CO2+2Na2O2=2Na2CO3+O2 (2分) (4)Al(OH)3+OH-=AlO2-+H2O (2分)
(5)正四面体 CH4+2O2
 CO2+2H2O (3分)
CO2+2H2O (3分)(6) HF HF分子之间存在氢键 (2分)
试题分析:A的原子半径最小,所以A是H元素;B是形成化合物种类最多的元素,则B是碳元素;C元素最外层电子数是次外层电子数的3倍,则C是氧元素;Z和C同主族,所以Z是S元素,因此W是氯元素;X、Y、W三元素原子的最外层共有11个电子,且三元素的最高价氧化物对应水化物之间两两皆能反应,均能生成盐和水。所以根据原子序数的大小关系可知,Y是Al,则S是Na元素。
点评:该题是高考中的常见题型,属于中等难度的试题。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。

练习册系列答案
相关题目
 族
族