题目内容
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是( )

A.pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+)
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-)
C.10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-)
D.V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
【答案】B
【解析】
A.MOH溶液中加入10mLHCl溶液时,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小,氯离子不电离也不水解,所以![]() ,故A错误;
,故A错误;
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐,![]() 水解导致溶液呈酸性,但水解程度较小,
水解导致溶液呈酸性,但水解程度较小,![]() 不水解,所以存在
不水解,所以存在![]() ,故B正确;
,故B正确;
C.![]() 时,溶液中溶质为MOH和MCl,且
时,溶液中溶质为MOH和MCl,且![]() ,溶液中存在物料守恒
,溶液中存在物料守恒![]() ,故C错误;
,故C错误;
D.![]() 时,HCl过量导致溶液呈酸性,根据电荷守恒得
时,HCl过量导致溶液呈酸性,根据电荷守恒得![]() ,溶液中溶质存在有
,溶液中溶质存在有![]() 、
、![]() 或
或![]() 三种情况,可能出现
三种情况,可能出现![]() ,故D错误;
,故D错误;
故选:B。

【题目】将装满气体X的试管倒置于装有液体Y的水槽中,充分振荡试管后,下列说法合理的是
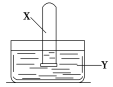
气体X | 液体Y | 试管内现象 | |
A | SO2 | 滴有品红的水溶液 | 无明显现象 |
B | NO2 | 水 | 充满无色溶液 |
C | NH3 | 滴有酚酞的水溶液 | 充满红色溶液 |
D | C2H4 | 酸性KMnO4溶液 | 无明显现象 |
A.AB.BC.CD.D
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。学习物质结构与性质,回答下列问题:
(1)太阳中的主要化学元素是氢和_______。
(2)氢负离子H-基态电子排布式为_______。
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为________。
(4)几种碱金属氢化物的部分性质如下表所示:
氢化物 | LiH | NaH | KH |
密度/g/cm3 | 0.78 | 1.43 | |
分解温度/℃ | 850 | 425 | 400 |
从化学结构的角度回答说明,分解温度LiH>NaH>KH___。
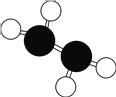
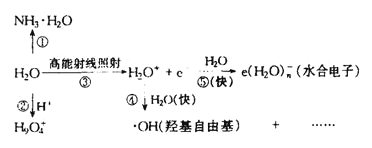
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是___,请画出H5O2+的结构式:______。当用高能射线照射液态水时,水分子便以一种新的方式电离,如图所示写出高能射线照射水的总反应的离子方程式_______。
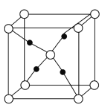
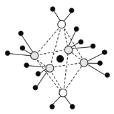
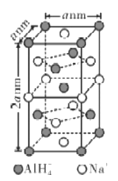
(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有___个,设阿伏伽德罗常数为NA,则晶体的密度为___g·cm-3。
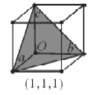
(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有___个。