题目内容
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)
(2)如果(A或B)不能,说明其原因
(3)如果(A或B)可以,则画出装装置图并写出正、负极的电极反应式
负极:
正极:
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)
不能
不能
(B)能
能
(2)如果(A或B)不能,说明其原因
(A)的反应非氧化还原反应,没有电子转移
(A)的反应非氧化还原反应,没有电子转移
(3)如果(A或B)可以,则画出装装置图并写出正、负极的电极反应式
负极:
Cu-2e-=Cu 2+.
Cu-2e-=Cu 2+.
正极:
2Fe 3++2e-=2Fe 2+
2Fe 3++2e-=2Fe 2+
.分析:(1)(2)从原电池反应必须是氧化还原反应的角度分析;
(3)根据原电池负极是较活泼金属,发生氧化反应,正极发生还原反应书写电极方程式.
(3)根据原电池负极是较活泼金属,发生氧化反应,正极发生还原反应书写电极方程式.
解答:解:(1)原电池是将化学能转变为电能的装置,只有氧化还原反应才有电子的转移,而(A)为非氧化还原反应,不能设计成原电池,(B)为氧化还原反应,可以设计成原电池,
故答案为:(A)不能(B)可以;
(2)原电池是将化学能转变为电能的装置,正极发生还原反应,负极发生氧化反应,A)为非氧化还原反应,没有发生电子的转移,故不能设计成原电池,
故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)在2FeCl3+Cu=2FeCl2+CuCl2反应中,FeCl3被还原,为正极反应,可用碳棒作正极,电极反应为2Fe3++2e-=2Fe2+
Cu被氧化,为原电池负极反应,电极反应为 Cu-2e-=Cu2+,选取参加还原反应的电解质溶液为原电池的电解质溶液.
故答案为:Cu-2e-=Cu2+,2Fe3++2e-=2Fe2+,该装置图为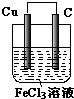
故答案为:(A)不能(B)可以;
(2)原电池是将化学能转变为电能的装置,正极发生还原反应,负极发生氧化反应,A)为非氧化还原反应,没有发生电子的转移,故不能设计成原电池,
故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)在2FeCl3+Cu=2FeCl2+CuCl2反应中,FeCl3被还原,为正极反应,可用碳棒作正极,电极反应为2Fe3++2e-=2Fe2+
Cu被氧化,为原电池负极反应,电极反应为 Cu-2e-=Cu2+,选取参加还原反应的电解质溶液为原电池的电解质溶液.
故答案为:Cu-2e-=Cu2+,2Fe3++2e-=2Fe2+,该装置图为

点评:本题考查原电池的设计,本题难度不大,注意原电池的组成特点和反应原理,注意电极反应式的书写,为常考查知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 现有如下两个反应:
现有如下两个反应: