题目内容
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。
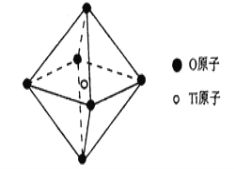
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
【答案】[Ar] 3d1 sp2 sp3 Cl>Mg>Al ![]() 18NA SrTiO3
18NA SrTiO3
【解析】
(1)Ti是22号元素,电子排布式为[Ar]3d24s2,Ti3+的基态核外电子排布式为[Ar]3d1。
(2)丙烯分子中,第2、3个碳原子有三个价键即为sp2杂化,第1个碳原子有四个价键即为sp3杂化。
(3)铜周期电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIIA族,因此Mg、Al、Cl第一电离能由大到小的顺序是Cl>Mg>Al。
(4)根据N = O或C2 = O,与CO互为等电子体的阴离子为CN或C22,再写其电子式。
(5)一个水有2个 σ键,1mol[Ti(H2O)6]Cl3中含有σ键的数目为(2×6 + 6)NA =18NA。
(6)该晶体的晶胞中Sr位于晶胞的顶点即![]() 个,O位于晶胞的面心即
个,O位于晶胞的面心即![]() 个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3。
个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3。
(1)Ti是22号元素,电子排布式为[Ar]3d24s2,Ti3+的基态核外电子排布式为[Ar]3d1,故答案为:[Ar]3d1。
(2)丙烯分子中,第2、3个碳原子有三个价键即为sp2杂化,第1个碳原子有四个价键即为sp3杂化,故答案为:sp2;sp3。
(3)铜周期电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIIA族,因此Mg、Al、Cl第一电离能由大到小的顺序是Cl>Mg>Al,故答案为:Cl > Mg > Al。
(4)根据N = O或C2 = O,与CO互为等电子体的阴离子为CN或C22,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(5)一个水有2个 σ键,1mol[Ti(H2O)6]Cl3中含有σ键的数目为(2×6 + 6)NA =18NA,故答案为:18NA。
(6)该晶体的晶胞中Sr位于晶胞的顶点即![]() 个,O位于晶胞的面心即
个,O位于晶胞的面心即![]() 个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3,故答案为:SrTiO3。
个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3,故答案为:SrTiO3。

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1B.6C.5D.4
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)