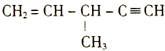题目内容
【题目】某研究性学习小组的同学利用MnO2和浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置(数量可满足需要,不含制气装置)如下,下列说法正确的是( )
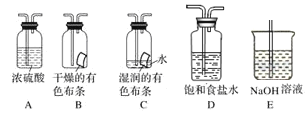
A. 装置E中发生反应的离子方程式为:Cl2+OH-=Cl-+ClO-+H2O
B. 按气流流动的先后顺序,装置连接顺序依次为DABAE
C. 装置E的主要用途是制备NaClO
D. 装置D的作用是除去氯气中的HCl并提供水蒸气以验证HClO具有漂白性
【答案】B
【解析】
A.电荷、原子不守恒,离子方程式应该为:Cl2+2OH-=Cl-+ClO-+H2O,A错误;
B.用浓盐酸与MnO2混合加热制取Cl2,由于盐酸具有挥发性,在Cl2中含有杂质HCl及水蒸气,先通过D装置除去HCl,再通过A装置除去水蒸气,得到干燥纯净的氯气,然后通过B验证Cl2是否具有漂白性,在通过C验证潮湿的氯气具有漂白性,由于氯气会导致大气污染,因此最后通过NaOH溶液进行尾气处理,故使用的装置的先后顺序为DABAE,B正确;
C.装置E的主要用途是吸收尾气,防止污染空气,C错误;
D.装置D的作用是除去氯气中的HCl,并抑制Cl2与水的反应的发生,D错误;
故合理选项是B。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
A | 2p能级电子半充满 |
B | 与A同周期,且原子核外有2个未成对电子 |
C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
D | 其基态原子外围电子排布为msnmpn+2 |
E | 前四周期元素中,E元素基态原子未成对电子数最多 |
F | 基态F+各能级电子全充满 |
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______种能量不同的电子,电子排布式为________________,写出F元素基态原子的价电子排布图________________。
(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为________。
(3)A、B、C、D四种元素:(用元素符号表示,下同)
①原子半径由小到大的顺序是___________________;
②第一电离能由大到小的顺序为__________________;
③电负性由大到小的顺序是____________________。
(4)判断下列分子或离子中空间构型是V形的是________(填写序号)。
a.SO2 b.H2O c.NO![]() d.NO
d.NO![]()
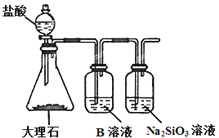
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。