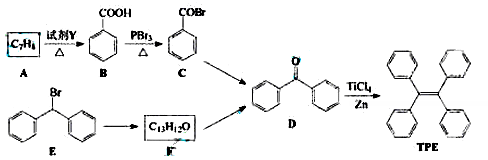
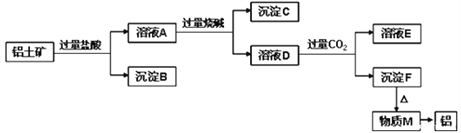
题目内容
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是 ( )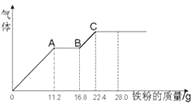
A.混合酸中HNO3物质的量浓度为1mol/L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+ , BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中H2SO4物质的量浓度为0.4mol/L
【答案】A
【解析】第一份加入铜粉,发生反应:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O,Cu的物质的量是0.3 mol,则一份溶液中硝酸根是0.2 mol,所以总的硝酸根是0.4 mol,NO3-物质的量浓度为2 mol/L,A错误;OA段和BC段都有气体生成,而AB段没有气体生成,整个过程发生的反应有Fe+4H++NO3-===Fe3++NO↑+2H2O、2Fe3++Fe===3Fe2+及Fe+2H+===Fe2++H2↑,所以AB段发生反应2Fe3++Fe===3Fe2+ , OA段发生反应Fe+4H++NO3-===Fe3++NO↑+2H2O,故BC段发生反应Fe+2H+===Fe2++H2↑,B正确;最终的铁以FeSO4的形式存在,C项正确;从图像可以看出,完全反应时,反应消耗Fe的质量是22.4 g(0.4 mol),硫酸根的物质的量也是0.4 mol(因为最终溶液中只有FeSO4),溶液体积是100 mL,故浓度是4 mol·L-1。答案为AD。

练习册系列答案
相关题目