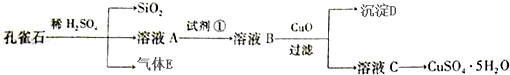
题目内容
18.(1)向FeCl2溶液中滴加氯水,(2)再滴加KSCN溶液,溶液变红.(3)加入铜粉,振荡,溶液红色消失.由此判断Fe3+、Cu2+、Cl2的氧化性顺序为:Cl2>Fe3+>Cu2+.所发生反应的相应的离子方程式为(1)2Fe2++Cl2=2Fe3++2Cl-(3)2Fe3++Cu=2Fe2++Cu2+.分析 氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,结合反应的方程式分析解答.
解答 解:(1)向FeCl2溶液中滴加氯水,发生反应2Fe2++Cl2=2Fe3++2Cl-,氧化性:Cl2>Fe3+;(2)再滴加KSCN溶液,溶液变红,证明(1)发生了氧化还原反应.(3)加入铜粉,振荡,溶液红色消失,发生的反应为:2Fe3++Cu=2Fe2++Cu2+,氧化性:Fe3+>Cu2+;所以Fe3+、Cu2+、Cl2的氧化性顺序为:Cl2>Fe3+>Cu2+;
故答案为:Cl2、Fe3+、Cu2+;2Fe2++Cl2=2Fe3++2Cl-;2Fe3++Cu=2Fe2++Cu2+.
点评 本题考查了亚铁离子和铁离子的检验、氧化还原反应,题目难度不大,注意把握常见离子的检验方法和氧化性强弱的比较方法.

练习册系列答案
相关题目
8.亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀毒.以下是用过氧化氢法生产亚氯酸钠的工艺流程图1:
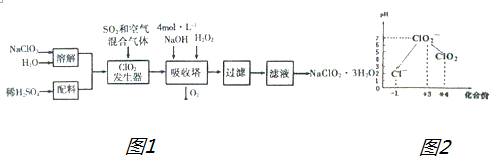
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O
②Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-20;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为2OH-+2ClO2+H2O2═2ClO2-+O2↑+2H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是edcf(填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.加热蒸发 f.洗涤干燥
(3)自来水厂也可用ClO2消毒杀菌,处理后的水中要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液进行滴定,发生2S2O32-+I2═S4O62-+2I-反应.
Ⅲ.加硫酸调节水样pH至1~3.操作时,不同pH环境中粒子种类如图2所示;请回答:
①操作Ⅱ滴定终点的现象是溶液蓝色刚好褪去,且保持30秒不变色.
②在操作Ⅱ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+=Cl-+2I2+2H2O.
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/LNa2S2O3溶液8ml,则水样中ClO2的浓度为0.54mg/L.
(4)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.
下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2)(用化学式表示);体积相等,物质的浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:前者大(填“前者”“相等”或“后者大”).
②Na2S是常用的沉淀剂,某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时,此时体系中的S2-的浓度为6.3×10-13mol/L.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O
②Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-20;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为2OH-+2ClO2+H2O2═2ClO2-+O2↑+2H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是edcf(填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.加热蒸发 f.洗涤干燥
(3)自来水厂也可用ClO2消毒杀菌,处理后的水中要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液进行滴定,发生2S2O32-+I2═S4O62-+2I-反应.
Ⅲ.加硫酸调节水样pH至1~3.操作时,不同pH环境中粒子种类如图2所示;请回答:
①操作Ⅱ滴定终点的现象是溶液蓝色刚好褪去,且保持30秒不变色.
②在操作Ⅱ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+=Cl-+2I2+2H2O.
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/LNa2S2O3溶液8ml,则水样中ClO2的浓度为0.54mg/L.
(4)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.
下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
②Na2S是常用的沉淀剂,某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时,此时体系中的S2-的浓度为6.3×10-13mol/L.
9.化学与生活密切相关.下列应用中利用了物质氧化性的是( )
| A. | 漂白粉漂白织物 | B. | 纯碱去油污 | C. | 食醋除水垢 | D. | 明矾净化水 |
13.下列说法正确的是( )
| A. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| B. | 在一定条件下,1.0 mol的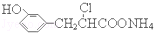 ,最多能与含2.0 mol NaOH的溶液完全反应 ,最多能与含2.0 mol NaOH的溶液完全反应 | |
| C. | 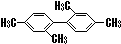 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
10.强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.向1L 0.5 mol•L-1的NaOH溶液中加入下列物质:①浓硫酸 ②稀硝酸,恰好完全反应的热效应依次为△H1、△H2,则二者的关系正确的是( )
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H2>△H1 | D. | 无法比较 |
7.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使红色石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
8. 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
(1)兴趣小组同学认为,上述反应的生成物可能与反应温度(T),KOH溶液的浓度(c)有关.他们做了如下对比实验(每次实验中硫粉的质量、KOH溶液的体积均相同).
实验①~④是探究温度对生成物的影响,⑤~⑧是探究KOH溶液的浓度对生成物的影响.请在表中相应空格内填人相应数据.
(2)兴趣小组设计实验对上述反应中生成的盐的成分进行探究.他们提出如下假设,请你根据
氧化还原反应的规律,L完成假设二和假设三:
假设一:生成的盐是K2S和K2S03;
假设二:生成的盐是K2S和K2S04;
假设三:生成的盐是K2S、K2S03和K2S04的混合物;
(3)请你设计实验验证上述假设一.完成下表中内容.[除了硫粉与热的KOH溶液的反应液之外,可供选择的药品有稀硝酸,稀盐酸等;已知:6H++SO32-+2S2-=3S+3H2O]
(4)兴趣小组通过改变硫粉的质量,得出生成钾盐的质量与硫粉质量的变化关系如图所示.有人据此得出结论:生成的盐一定是K2S和K2SO3的混合物.请你根据计算结果指出该结论是否正确不正确;3.2g硫完全反应,不管生成硫化钾和亚硫酸钾的混合物、硫化钾和硫酸钾的混合物还是硫化钾、亚硫酸钾和硫酸钾的混合物,其质量都是12.6g.
(5)请分析上述反应中有K2S04生成的可能原因是亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.
 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.(1)兴趣小组同学认为,上述反应的生成物可能与反应温度(T),KOH溶液的浓度(c)有关.他们做了如下对比实验(每次实验中硫粉的质量、KOH溶液的体积均相同).
实验①~④是探究温度对生成物的影响,⑤~⑧是探究KOH溶液的浓度对生成物的影响.请在表中相应空格内填人相应数据.
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| T/℃ | 50 | 60 | 70 | 80 | 90 |
| c/mol.L-1 | 1.0 | 3.0 |
氧化还原反应的规律,L完成假设二和假设三:
假设一:生成的盐是K2S和K2S03;
假设二:生成的盐是K2S和K2S04;
假设三:生成的盐是K2S、K2S03和K2S04的混合物;
(3)请你设计实验验证上述假设一.完成下表中内容.[除了硫粉与热的KOH溶液的反应液之外,可供选择的药品有稀硝酸,稀盐酸等;已知:6H++SO32-+2S2-=3S+3H2O]
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
(5)请分析上述反应中有K2S04生成的可能原因是亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.