题目内容
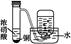
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( )
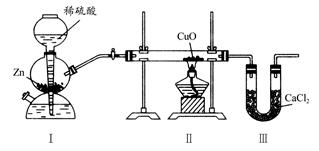

| A.Ⅰ、Ⅱ装置之间缺少干燥装置 |
| B.Ⅲ装置后缺少干燥装置 |
| C.Ⅱ装置中玻璃管内有水冷凝 |
| D.CuO没有全部被还原 |
D
用H2还原CuO时,装置Ⅲ中CaCl2吸收的是生成的水,而装置Ⅱ中玻璃管通H2前后的质量差为反应时消耗CuO中氧的质量,即生成水中氧元素的质量,而m(水)-m(氧)=m(氢)。当Zn和稀硫酸反应产生的H2不干燥[m(水)偏大],装置Ⅲ后不加干燥装置,使Ⅲ中CaCl2吸收空气中的水分[m(水)偏大],Ⅱ中玻璃管内有水冷凝[m(氧)偏小],都会造成测得m(H):m(O)>1:8。H2O的组成与CuO是否完全反应无关,只与通H2前后玻璃管的质量差和生成的水有关。

练习册系列答案
相关题目
 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)


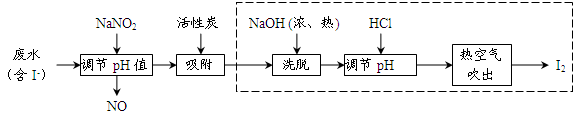
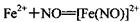 (棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。
(棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。