题目内容
【题目】电解Na2SO4溶液产生H2SO4和烧碱的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2。以下说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
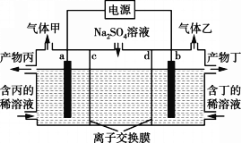
A. 产物丁为H2SO4
B. a电极反应式:2H2O+2e-=H2↑+2OH-
C. 离子交换膜d为阳离子交换膜
D. 每转移0.2 mol电子,产生1.12 L气体甲
【答案】C
【解析】
电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 2H2O+2e-=H2↑+2OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成产物丙为硫酸、阴极区域生成产物丁为NaOH。
A项、产物丁是NaOH,故A错误;
B项、a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故B错误;
C项、产物丁是NaOH,则离子交换膜d是阳离子交换膜,故C正确;
D项、温度和压强未知,无法确定气体摩尔体积,则无法计算氧气体积,故D错误。
故选C。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】部分中学化学常见元素原子结构及性质如表所示
元素 | 结构及性质 |
A | A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | D与B同主族,且通常状况下D没有正化合价 |
E | E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理 |
F | F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)C元素在周期表中的位置_____________;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________(用相应化学式表示)
(3)请画出化合物F2B2的电子式__________,该化合物中含有的化学键类型是_______。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________(填“A”或“C”),写出该原电池总反应的离子方程式____________________。