题目内容
【题目】铜和锌在工业中有重要作用。回答下列问题:
(1)已知氢氧化铜能溶于氨水形成[Cu(NH3)4]2+,则1mol[Cu(NH3)4]2+中含有______个σ键。
(2)CuO和Cu2O都能溶于盐酸,且Cu2O易发生歧化反应,写出Cu2O与盐酸反应的离子方程式________。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”),原因是_______________________。
(4)ZnF2具有较高的熔点(872℃),而ZnCl2、ZnBr2、ZnI2熔点都比较低,原因是________________。
(5)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为_____________,C原子的杂化形式为_____________。
【答案】16NACu2O+2H+=Cu+Cu2++H2O大于Zn核外电子排布为全满稳定结构,较难失电子ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,属于共价化合物平面三角形sp2
【解析】
(1) [Cu(NH3)4]2+的结构为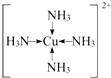 ,N-H键及配位键属于σ键,1mol该离子中含有12molN-H键、4mol配位键,共含有σ键为16mol,数目为16NA,故答案为:16NA;
,N-H键及配位键属于σ键,1mol该离子中含有12molN-H键、4mol配位键,共含有σ键为16mol,数目为16NA,故答案为:16NA;
(2)Cu2O在酸溶液中发生歧化反应,Cu2O与盐酸反应的离子方程式, Cu2O+2H+═Cu2++Cu+H2O,故答案为:Cu2O+2H+═Cu2++Cu+H2O、
(3)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态,所以Cu较Zn易失电子,则第一电离能Cu<Zn,故答案为:大于;Zn原子轨道中电子处于全满状态,较难失电子,Cu失去一个电子内层电子达到全充满稳定状态;
(4)熔沸点较高ZnF2为离子晶体,离子晶体熔沸点较高,而ZnCl2、ZnBr2、ZnI2为共价化合物,熔点较低,故答案为:ZnF2属于离子化合物,ZnCl2、ZnBr2、ZnI2为共价化合物;
(5)ZnCO3中,阴离子CO32-中C原子价层电子对个数=3+![]() =3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式分别为平面正三角形、sp2杂化,故答案为:平面正三角形;sp2。
=3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式分别为平面正三角形、sp2杂化,故答案为:平面正三角形;sp2。

 阅读快车系列答案
阅读快车系列答案【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.0×10-5 |
(1)将含镍废料粉碎的目的是_______________________________________________。
(2)“酸浸”实验中,镍的浸出率结果如图所示,从能量损耗和成本角度考虑,若要使镍的浸出效果最佳,选择的最好温度和时间分别为______℃、______ min。

(3)实验过程中,滤渣1主要成分的化学式为________、________。
(4)调节pH步骤中,溶液pH的调节范围是_____~______。选择此范围的目的是__________________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:______________________________。
(6)沉镍过程中,若c(Ni2+)=4.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为_____g。(保留小数点后1位有效数字)