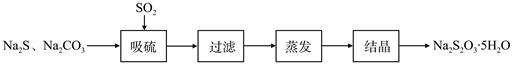
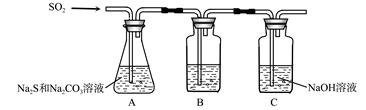
题目内容
在体积为100mL浓度为18mol·L-1的浓硫酸中加入过量铜片并加热,问被还原的硫酸的物质的量为( )
A、等于0.9mol B、大于0.9mol C、小于0.9mol D无法确定
A、等于0.9mol B、大于0.9mol C、小于0.9mol D无法确定
C
试题分析:Cu与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O。n(H2SO4)=0.1L×18mol/L=1.8mol。因为Cu足量。所以若浓硫酸完全反应,被还原的硫酸的物质的量为0.9mol.但是只有浓硫酸才发生上述反应,随着反应的进行,硫酸变稀,这时反应就不再进行。因此被还原的硫酸的物质的量小于0.9mol。故选项为C。
CuSO4+SO2↑+2H2O。n(H2SO4)=0.1L×18mol/L=1.8mol。因为Cu足量。所以若浓硫酸完全反应,被还原的硫酸的物质的量为0.9mol.但是只有浓硫酸才发生上述反应,随着反应的进行,硫酸变稀,这时反应就不再进行。因此被还原的硫酸的物质的量小于0.9mol。故选项为C。
练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
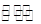 N2O4的
N2O4的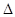 H<0
H<0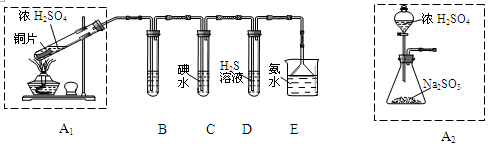
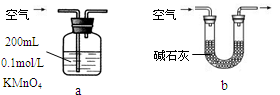
 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为