题目内容
【题目】利用海洋资源可以获得很多物质![]() 如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等.
如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等.
![]() 一
一![]() 从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2 CO3、③NaOH、④BaCl2来除去食盐水中的
从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2 CO3、③NaOH、④BaCl2来除去食盐水中的![]() 、
、![]() 、
、![]() .
.
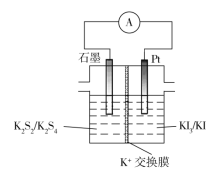
(1)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______
a.先加 NaOH,后加Na2 CO3,再加 BaCl2
b.先加NaOH,后加BaCl2,再加Na2 CO3
C.先加BaCl2,后加NaOH,再加Na2 CO3
(2)判断试剂BaCl2己经足量的方法是______________________。
![]() 二
二![]() 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在![]() 实验室里从海带中提取碘的流程如下:
实验室里从海带中提取碘的流程如下:
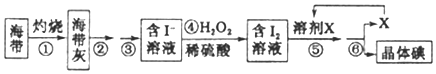
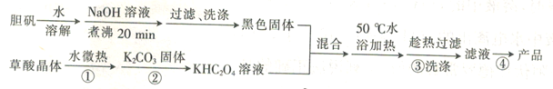
(1)实验时灼烧海带应在______________(填仪器名称)内进行
(2)步骤④中反应的离子方程式是_______________________________。
(3)步骤⑤的实验操作为____________,应选用的一种溶剂X可以是_____________。
a.苯、酒精 b.四氯化碳、苯 c.汽油、酒精
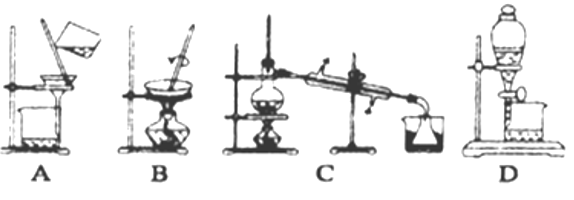
(4)步骤⑥的实验操作应选用如图中的______。
【答案】bc 静置,在上层淸液中滴加BaCl2溶液,若不再产生白色沉淀,则BaCl2己足量 坩埚 2I+H2O2+2H+=I2+2H2O )萃取分液 b C
【解析】
(二)海带在坩埚中灼烧得到海带灰,溶于水过滤得到含碘离子的溶液,加入过氧化氢氧化碘离子生成碘单质,加入萃取剂萃取分液得到含碘单质的四氯化碳溶液,蒸馏得到碘单质,萃取剂循环使用。
(一)(1)先加入过量的氢氧化钠可以除去镁离子,加入氯化钡可以除去硫酸根离子,加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡,(注意碳酸钠必须加在氯化钡的后面)最后加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠,所以选bc;
(2)判断试剂BaCl2己经足量的方法是:静置,在上层淸液中滴加BaCl2溶液,若不再产生白色沉淀,则BaCl2己足量;
(二)实验时灼烧海带应在坩埚中灼烧;
(2)步骤④中反应是过氧化氢氧化碘离子生成碘单质,反应的离子方程式是:2I++H2O2+2H+=I2+2H2O;
(3)步骤⑤的实验操作为萃取分液,溶剂X需要满足不溶于水,碘单质在其中溶解性大于水中,可以是b四氯化碳或苯,a和c中的酒精易溶于水不能做萃取剂;
(4)步骤⑥的实验操作是利用物质沸点不同蒸馏的方法分离混合物,选C。

【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入 | 该溶液中一定含有 |
A.AB.BC.CD.D