题目内容
下表是元素周期表的一部分,请从下表①~⑩十种元素中选择适当的元素回答下列问题:
 (1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;
(1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的离子方程式 ▲ ;
(3)元素⑨形成的单质中存在的化学键为 ▲ ;
(4)物质熔沸点的高低与该物质的晶体结构有关,④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 ▲ 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,现用实验证明上述猜想是否正确,你的实验方案是 ▲ 。
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A |
| 一 | ① | | |||||
| 二 | ② | ③ | ④ | | ⑤ | ⑥ | |
| 三 | | ⑦ | ⑧ | | | ⑨ | ⑩ |
 (1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;
(1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;(2)已知某些不同族元素的性质也有一定的相似性,如元素③与⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的离子方程式 ▲ ;

(3)元素⑨形成的单质中存在的化学键为 ▲ ;

(4)物质熔沸点的高低与该物质的晶体结构有关,④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 ▲ 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,现用实验证明上述猜想是否正确,你的实验方案是 ▲ 。
(1)1s22s22p3,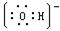 (2).Be(OH)2+2OH-=BeO22-+2H2O
(2).Be(OH)2+2OH-=BeO22-+2H2O
(3)共价键(或非极性共价键)
(4)原子。测定熔融状态下该物质的导电性,如果不导电,说明是共价化合物,与NaCl晶体类型不同(其他合理答案同样给分)。(每空均2分)
入选理由:把“物质结构”知识的考察,结合必修内容,比较全面。
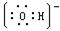 (2).Be(OH)2+2OH-=BeO22-+2H2O
(2).Be(OH)2+2OH-=BeO22-+2H2O(3)共价键(或非极性共价键)
(4)原子。测定熔融状态下该物质的导电性,如果不导电,说明是共价化合物,与NaCl晶体类型不同(其他合理答案同样给分)。(每空均2分)
入选理由:把“物质结构”知识的考察,结合必修内容,比较全面。
做这个题目是,不妨先把①-⑩所代表的元素列出来,依次为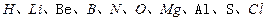 ,(1)就可以写出来N :1s22s22p3,⑥与①形成的10电子阴离子就是
,(1)就可以写出来N :1s22s22p3,⑥与①形成的10电子阴离子就是 ,所以电子式就为
,所以电子式就为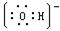 ,(2)不妨先写出
,(2)不妨先写出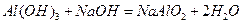 这个方程式,进而写出其离子方程式
这个方程式,进而写出其离子方程式
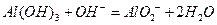 ,这个时候我们只要不
,这个时候我们只要不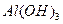 换成Be(OH)2,就可以写出
换成Be(OH)2,就可以写出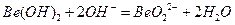 ;(3)元素⑨形成的单质是硫的单质,只存在共价键,也可以说非极性共价键;(4)④的单质晶体熔点为2573K,沸点2823K,硬度大,以上信息可以确定该晶体是原子晶体。NaCl是离子晶体,判断一种晶体是不是离子晶体,就2看其在熔融状态下是否导电。
;(3)元素⑨形成的单质是硫的单质,只存在共价键,也可以说非极性共价键;(4)④的单质晶体熔点为2573K,沸点2823K,硬度大,以上信息可以确定该晶体是原子晶体。NaCl是离子晶体,判断一种晶体是不是离子晶体,就2看其在熔融状态下是否导电。
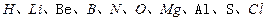 ,(1)就可以写出来N :1s22s22p3,⑥与①形成的10电子阴离子就是
,(1)就可以写出来N :1s22s22p3,⑥与①形成的10电子阴离子就是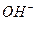 ,所以电子式就为
,所以电子式就为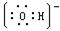 ,(2)不妨先写出
,(2)不妨先写出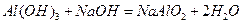 这个方程式,进而写出其离子方程式
这个方程式,进而写出其离子方程式
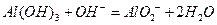 ,这个时候我们只要不
,这个时候我们只要不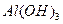 换成Be(OH)2,就可以写出
换成Be(OH)2,就可以写出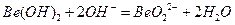 ;(3)元素⑨形成的单质是硫的单质,只存在共价键,也可以说非极性共价键;(4)④的单质晶体熔点为2573K,沸点2823K,硬度大,以上信息可以确定该晶体是原子晶体。NaCl是离子晶体,判断一种晶体是不是离子晶体,就2看其在熔融状态下是否导电。
;(3)元素⑨形成的单质是硫的单质,只存在共价键,也可以说非极性共价键;(4)④的单质晶体熔点为2573K,沸点2823K,硬度大,以上信息可以确定该晶体是原子晶体。NaCl是离子晶体,判断一种晶体是不是离子晶体,就2看其在熔融状态下是否导电。
练习册系列答案
相关题目
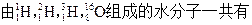
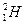 )受控核聚变成氦(
)受控核聚变成氦(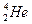 ),下列说法中不正确的是( )
),下列说法中不正确的是( )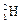 )受控核聚变成氦(
)受控核聚变成氦( 2和
2和