题目内容
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如下图所示,仔细观察下图,判断有关说法中不正确的是( )
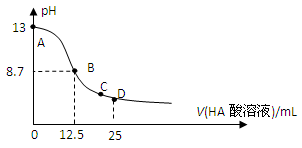
A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.在D点:c(A-)+c(HA)=2c(Na+)

A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.在D点:c(A-)+c(HA)=2c(Na+)
C
A项:如果HA是强酸,则在12.5ml时两者恰好中和,溶液呈中性,pH=7,故HA为弱酸;
B项:当滴定过程中溶液pH=7时,溶液中的c(OH-)=c(H+),由电荷守恒可推之c(Na+)=c(A-);
C项:由于不能确定此时溶液的酸碱性,故无法排出微粒浓度关系。
D项:在D点,HA的物质的量为 NaOH的两倍,由物料守恒可知,c(A-)+c(HA)=2c(Na+)
B项:当滴定过程中溶液pH=7时,溶液中的c(OH-)=c(H+),由电荷守恒可推之c(Na+)=c(A-);
C项:由于不能确定此时溶液的酸碱性,故无法排出微粒浓度关系。
D项:在D点,HA的物质的量为 NaOH的两倍,由物料守恒可知,c(A-)+c(HA)=2c(Na+)

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目