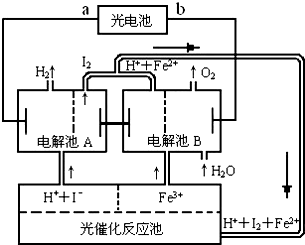
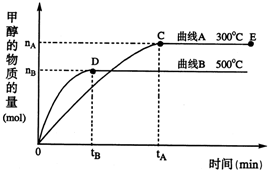
题目内容
(1)家用液化气的主要成分之一是丁烷,当58g丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2900kJ,试写出表示丁烷燃烧热的热化学方程式:______
(2)稀盐酸和NaOH稀溶液反应生成1mol水放热57.3KJ,该反应的热化学方程式为______.
(2)稀盐酸和NaOH稀溶液反应生成1mol水放热57.3KJ,该反应的热化学方程式为______.
(1)58g丁烷物质的量为1mol,完全燃烧并生成二氧化碳和液态水时,放出热量为2900kJ,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,反应的热化学方程式根据燃烧热写为:C4H10(g)+
O2(g)═4CO2(g)+5H2O;△H=-2900kJ/mol;故答案为:C4H10(g)+
O2(g)═4CO2(g)+5H2O(l);△H=-2900kJ/mol;
(2)稀盐酸和NaOH稀溶液反应生成1mol水放热57.3KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;
| 13 |
| 2 |
| 13 |
| 2 |
(2)稀盐酸和NaOH稀溶液反应生成1mol水放热57.3KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目