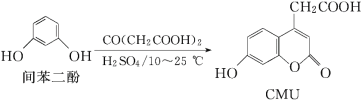题目内容
【题目】下列叙述正确的是( )
①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率
②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解
⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
A.全部B.①③④⑤C.①②⑤D.②④
【答案】B
【解析】
① 锌可以置换出铜,形成原电池,原电池反应比一般化学反应的速率快;
② 金属越活泼越易腐蚀;
③ 电镀时,镀件金属置于电解槽的阴极,镀层金属为电解槽的阳极;
④ 电解氧化铝,为了降低其熔点,用冰晶石(![]() );
);
⑤ 铁锈的主要成分(![]() )。
)。
① 锌与硫酸铜溶液发生置换反应,其离子反应方程式为:![]() ,形成原电池,加快反应速率,①正确;
,形成原电池,加快反应速率,①正确;
② 金属活动性:![]() ,镀层破损后,白口铁(镀锌的铁)中
,镀层破损后,白口铁(镀锌的铁)中![]() 为原电池的负极,仍能保护
为原电池的负极,仍能保护![]() ,而马口铁(镀锡的铁)中
,而马口铁(镀锡的铁)中![]() 为原电池的负极,加快
为原电池的负极,加快![]() 的腐蚀,马口铁(镀锡的铁)比白口铁(镀锌的铁)更易腐蚀,②错误;
的腐蚀,马口铁(镀锡的铁)比白口铁(镀锌的铁)更易腐蚀,②错误;
③ 电镀时,镀件金属为电解池的阴极,镀层金属为电解池的阳极,在阴极上析出镀层金属,③正确;
④ 冶炼金属铝,电解熔融的氧化铝,为了降低其熔点,氧化铝加入液态冰晶石(![]() )熔融后电解;④正确;
)熔融后电解;④正确;
⑤ 钢铁表面常因发生原电池而被腐蚀,由于![]() 比杂质
比杂质![]() 活泼,所以
活泼,所以![]() 作原电池的负极被氧化,最终得到铁锈(
作原电池的负极被氧化,最终得到铁锈(![]() ),⑤正确。
),⑤正确。
因此正确的是:①③④⑤。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____。
③向NaCN溶液通入少量CO2反应的化学方程式是_______。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____,此时,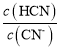 =_____。
=_____。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
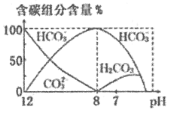
回答下列问题:
在同一溶液中H2CO3、![]() 、
、![]() ______(填“能”或“不能”)大量共存。
______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____,溶液中各种离子(![]() 除外)的物质的量浓度的大小关系为______。
除外)的物质的量浓度的大小关系为______。
③已知在25℃时,![]() 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c(![]() ):c(
):c(![]() )=2:1时,溶液pH=______。
)=2:1时,溶液pH=______。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________mol/L。