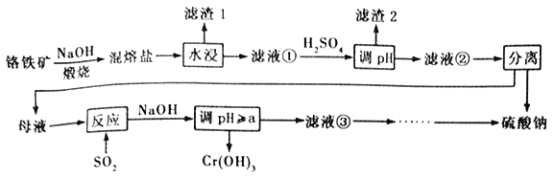
��Ŀ����
����Ŀ��I.�ʻ���(COS)����ΪѬ���������ӽṹ��CO2�������ش��������⣺
��1��̼ԭ�ӵĺ�������Ų�ʽΪ____________������ʻ����Ԫ���У��뾶����ԭ���������_____�ֲ�ͬ�����ĵ��ӡ�
��2���ʻ���Ϊ___(���������������Ǽ�����)���ӣ��ʻ���ĵ���ʽΪ_____________��
��3�������ȶ���CO2����CS2��ԭ��________________________________________��
II.�ܱ������У�������Ӧ��CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
��4����֪�淴Ӧ������ʱ��仯��ͼ��ʾ����t0ʱ�ı������������_____________��________________��

��5���÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ�H2SŨ�����ӣ������÷�Ӧ��___���������������������ȷ�Ӧ��ƽ�ⳣ��K��____(����������������С������������)�����ڷ�Ӧ��ϵ��ͨ��һ����SO2(g)���ж�ƽ���ƶ��ķ�����ԭ�� ________________________
���𰸡� 1s22s22p2 5 ���� ![]() C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2 ������� ��С�������������ѹǿ�� �� ��С �����ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���
C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2 ������� ��С�������������ѹǿ�� �� ��С �����ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���
����������1��̼ԭ�Ӻ˵����Ϊ6����������Ų�ʽΪ1s22s22p2��C��O��S����ԭ������Sԭ�ӵ��Ӳ������S��ԭ�Ӱ뾶�������������Ų�Ϊ��1s22s22p63 s23p4����ԭ��ԭ���������5�ֲ�ͬ�����ĵ��ӣ���ȷ�𰸣�1s22s22p2 �� 5��
��2���ʻ�����ӽṹ��![]() ������Ϊֱ���ͽṹ���ṹʽΪ:
������Ϊֱ���ͽṹ���ṹʽΪ:![]() ,��COS �ĵ���ʽΪ
,��COS �ĵ���ʽΪ![]() ����O��S�õ��ӵ�������ͬ����Ϊ��C��O֮����C��S֮��ļ��Լ��ļ��Է�������ȷ����������
����O��S�õ��ӵ�������ͬ����Ϊ��C��O֮����C��S֮��ļ��Լ��ļ��Է�������ȷ����������![]() ��
��
��3��ԭ�Ӱ뾶��S>C>O������C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2 ����ȷ����C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2��
II.��4��t0ʱ���淴Ӧ����ͻȻ�����Ҳ��䣬˵��ƽ�ⲻ�������ڸ÷�ӦΪ��Ӧǰ���������Ŀ��淴Ӧ�����Կ�����С������������ڴ�����ƽ���ƶ���Ӱ�죬���ǿ��Լӿ췴Ӧ���ʣ����Ҳ���Լ����������ȷ�𰸣���������� ��С�������������ѹǿ����
��5������CO(g)+H2S(g)![]() COS(g)+H2(g) ��Ӧ���÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ�H2SŨ�����ӣ���Ӧ����������÷�ӦΪ���ȷ�Ӧ��ƽ�ⳣ��K����С�����ڷ�Ӧ��ϵ��ͨ��һ����SO2(g)����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ�����ȷ�𰸣��� ����С�������ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���
COS(g)+H2(g) ��Ӧ���÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ�H2SŨ�����ӣ���Ӧ����������÷�ӦΪ���ȷ�Ӧ��ƽ�ⳣ��K����С�����ڷ�Ӧ��ϵ��ͨ��һ����SO2(g)����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ�����ȷ�𰸣��� ����С�������ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���

����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��SO2����ͨ��Ba(NO3)2��Һ | �а�ɫ���� | SO2�л���SO3 |
B | ��NaAlO2��Һ�г���ͨ������Y | �ȳ��ְ�ɫ���������ճ������ܽ� | Y������CO2���� |
C | AgCl����Һ�е�������Na2S��Һ | �������ɫ | Ksp(Ag2S)>Ksp(AgCl) |
D | ��ʢ��KI3��Һ�����Թ��зֱ���������Һ��AgNO3��Һ | ǰ����Һ����ɫ�������л�ɫ���� | KI3��Һ�д���ƽ��: I3�� |
A. A B. B C. C D. D