题目内容
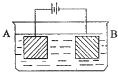
(1)如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极.接通电源后,甲中现象是b电极上产生刺激性气味气体.据此回答问题: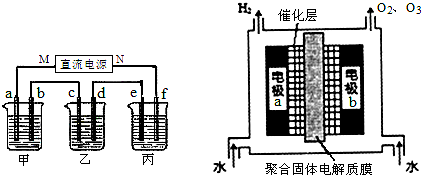
①电源的N端为______极;
②电极c上的现象为______;
③乙中总反应的化学方程式为______;
④往甲中加入______,可使溶液恢复原状.如果乙装置电解过程中铜全部析出,此时电解能不能继续进行(填“能”、“不能”)______.
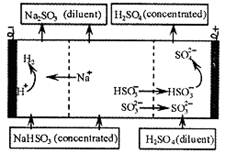
(2)臭氧是常见的强氧化剂.制取臭氧的方法之一是电解纯水(原理如下图).
①电极a为______极(填“阴”或“阳”)
②写出电极b生成臭氧的电极反应式______;电极b附近的溶液呈______性(填“酸”或“碱”).

①电源的N端为______极;
②电极c上的现象为______;
③乙中总反应的化学方程式为______;
④往甲中加入______,可使溶液恢复原状.如果乙装置电解过程中铜全部析出,此时电解能不能继续进行(填“能”、“不能”)______.
(2)臭氧是常见的强氧化剂.制取臭氧的方法之一是电解纯水(原理如下图).
①电极a为______极(填“阴”或“阳”)
②写出电极b生成臭氧的电极反应式______;电极b附近的溶液呈______性(填“酸”或“碱”).
(1)①接通电源后,甲中现象是b电极上产生刺激性气味气体说明该电极上有氯气生成,该电极为阳极,阳极连接原电池正极,所以N端为正极,故答案为:正;
②C为阴极,阴极上铜离子得电子而析出铜,所以C电解上析出红色物质,故答案为:电极c上覆盖一层红色物质;
③阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,则电池反应式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
④甲池中,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,所以相当于析出氯化氢,根据“析出什么加入什么”的原则知,应该通入氯化氢气体,乙装置电解过程中铜全部析出,溶液变为稀硫酸溶液,仍然能进行电解,故答案为:HCl(氯化氢气体);能;
(2)①a电极上氢离子得电子放电生成氢气,所以a电极连接阴极,故答案为:阴;
②b电极上氢氧根离子放电生成水和臭氧,电极反应式为:6OH-→3H2O+O3↑+6e-或6OH-=3H2O+O3↑+6e-,水电离出的氢氧根离子放电导致氢离子剩余,所以溶液呈酸性,故答案为:6OH-→3H2O+O3↑+6e-或6OH-=3H2O+O3↑+6e-;酸.
②C为阴极,阴极上铜离子得电子而析出铜,所以C电解上析出红色物质,故答案为:电极c上覆盖一层红色物质;
③阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,则电池反应式为:2CuSO4+2H2O
| ||
| ||
④甲池中,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,所以相当于析出氯化氢,根据“析出什么加入什么”的原则知,应该通入氯化氢气体,乙装置电解过程中铜全部析出,溶液变为稀硫酸溶液,仍然能进行电解,故答案为:HCl(氯化氢气体);能;
(2)①a电极上氢离子得电子放电生成氢气,所以a电极连接阴极,故答案为:阴;
②b电极上氢氧根离子放电生成水和臭氧,电极反应式为:6OH-→3H2O+O3↑+6e-或6OH-=3H2O+O3↑+6e-,水电离出的氢氧根离子放电导致氢离子剩余,所以溶液呈酸性,故答案为:6OH-→3H2O+O3↑+6e-或6OH-=3H2O+O3↑+6e-;酸.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目