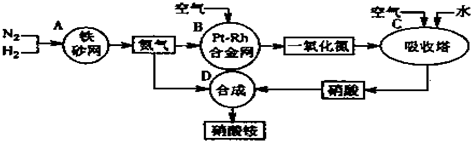
题目内容
16.用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示.下列说法中正确的是( )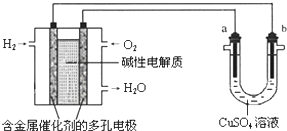
| A. | 燃料电池工作时,负极反应为:H2-2e-=2H+ | |
| B. | 若要实现铁上镀铜,则a极是铁,b极是铜 | |
| C. | 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,在相同条件下当电池中消耗H2 22.4 L(标准状况)时,a极析出铜64 g |
分析 碱性氢氧燃料电池中,通入H2的一极为原电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+H2O=4OH-,总反应式为2H2+O2=2H2O,作为a为电解池的阳极,发生氧化反应,b为电解池的阴极,发生还原反应,电极反应式为Cu2++2e-=Cu.
解答 解:A.燃料电池工作时负极反应为H2-2e-+2OH-=2H2O,故A错误;
B.若要实现铁上镀铜,镀层金属应为电解池的阳极,则a极是铜,b极是铁,故B错误;
C.a极为粗铜,连接原电池的正极,发生氧化反应,a极逐渐溶解,b极为电解池的阴极,发生Cu2++2e-=Cu,则b极上有铜析出,故C正确;
D.a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,根据电极反应式H2-2e-+2OH-=2H2O,可知转移2mol电子,则b极析出铜1mol,即64g,故D错误.
故选C.
点评 本题考查原电池和电解池的知识,题目难度中等,解答此种类型的题目的关键是能把握电化学原理,能正确书写电极反应式.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
4.在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 正极附近的SO42-浓度逐渐增大 | B. | 电子通过导线由铜片流向锌片 | ||
| C. | 正极有O2逸出 | D. | 铜片上有H2逸出 |
11.下列图示与对应的叙述不相符的是( )
| A. |  四种基本反应类型有氧化还原反应的关系 | |
| B. |  AlCl3溶液中滴加NaOH溶液生成沉淀的情况 | |
| C. | 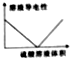 Ba(OH)2溶液中滴加硫酸溶液时的导电性情况 | |
| D. |  等体积、等浓度的稀硫酸分别与足量的铁和镁反应的情况 |
1.下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质的是( )
| A. | FeSO4 | B. | MgSO4 | C. | AlCl3 | D. | NH4Cl |
8.意大利科学家最近合成了一种新型的氧分子,其化学式为O4,下列关于O4的说法正确的是( )
| A. | 一个分子O4由两个分子O2构成 | |
| B. | O4是一种单质 | |
| C. | 等体积的O4和O2含有相同数目的分子 | |
| D. | 等质量的O4和O2含有相同数目的氧原子 |
3.关于如图所示装置的叙述,错误的是( )


| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原,产生气泡 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电子从锌片经硫酸溶液流向铜片 |
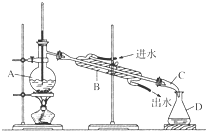 某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题:
某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题: