题目内容
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是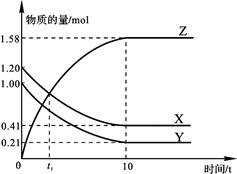
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s) |
| B.反应开始到10 s时,Y的转化率为79.0% |
| C.t1时,Z和X的浓度相等,达到了化学平衡状态 |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
B
解析试题分析:A、10s内,用Z表示的反应速率为v(Z)=1.58mol÷2L÷10s=0.079moL/(L?s),错误;B、反应开始到10 s时,Y消耗物质的量1.0mol-0.21mol=0.79mol,Y的转化率=0.79mol÷1.0mol×100%=79.0%,正确;C、t1时,Z和X的浓度相等,在t1时刻之后,X的物质的量进行减小,Z的物质的量进行增大,反应向正反应进行,反应未达到了化学平衡状态,错误;D、由图象可以看出,由图表可知,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)?2Z(g),错误。
考点:本题考查图像的分析、化学反应速率、化学平衡。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案为了说明影响化学反应快慢的因素,甲、乙、丙、丁4位同学分别设计了如下4个实验,你认为结论不正确的是( )
| A.将形状、大小均相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样 |
| B.在相同条件下,等质量的大理石块和大理石粉末与相同浓度的盐酸反应,大理石粉末反应快 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两只试管中分别加入相同质量的氯酸钾,其中一只试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
一定条件下,可逆反应N2 + 3H2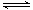 2NH3达到化学平衡状态,下列说法一定正确的是( )
2NH3达到化学平衡状态,下列说法一定正确的是( )
| A.每1 mol N≡N断裂的同时有2 mol N—H生成 |
| B.N2、H2、NH3的浓度之比为1:3:2 |
| C.N2减少的速率和NH3减少的速率之比为1:2 |
D.气体体积为初始体积的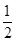 |
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
| A.60 s内X的平均反应速率为0.001 mol·L-1·s-1 |
| B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2 |
| C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
用足量的铁片与一定量的稀硫酸反应制氢气,下列措施既能使氢气的生成速率加快,又不影响氢气的产量的是( )
| A.滴入适量Na2SO4溶液 | B.不用稀硫酸,改用98%的浓硫酸 |
| C.加入少量碳酸钠固体 | D.不用铁片,改用等质量的铁粉 |
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:
N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )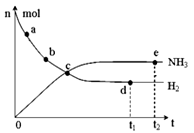
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到化学平衡状态 |
| C.点d和点e处的n(N2)不相同 |
| D.点e反应达到化学平衡状态,反应停止 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1 |
100 mL 2 mol/L H2SO4与过量Zn粉反应,在一定温度下,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是( )
| A.加入碳酸钠固体 | B.改用18 mol/L的浓H2SO4 |
| C.滴入少量硫酸铜溶液 | D.加入硫酸钾溶液 |
 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是