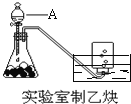
题目内容
【题目】下列氧化还原反应方程式,所标电子转移方向与数目错误的是( )
A.
B.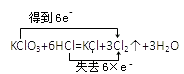
C.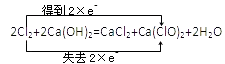
D.
【答案】B
【解析】解:A.该反应中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,得失电子的最小公倍数是2,  中电子转移方向与数目正确,故A正确;B.该反应中Cl元素化合价由+5价、﹣1价变为0价,得失电子总数是5,其电子转移方向和数目为
中电子转移方向与数目正确,故A正确;B.该反应中Cl元素化合价由+5价、﹣1价变为0价,得失电子总数是5,其电子转移方向和数目为 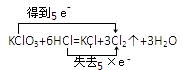 ,故B错误;
,故B错误;
C.该反应中Cl元素化合价由0价变为+1价、﹣1价,得失电子总数是2,转移电子方向和数目为 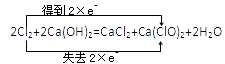 ,故C正确;
,故C正确;
D.该反应中N元素化合价由+2价变为+5价、O元素化合价由0价变为﹣2价,得失电子总数是12,转移电子方向和数目为  ,故D正确;
,故D正确;
故选B.
A.该反应中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,得失电子的最小公倍数是2;
B.该反应中Cl元素化合价由+5价、﹣1价变为0价,得失电子总数是5;
C.该反应中Cl元素化合价由0价变为+1价、﹣1价,得失电子总数是2;
D.该反应中N元素化合价由+2价变为+5价、O元素化合价由0价变为﹣2价,得失电子总数是12.

 名校课堂系列答案
名校课堂系列答案【题目】(1)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是__________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(2)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是__________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A.CH3COOH + Na2CO3 ==NaHCO3 + CH3COONa
B.CH3COOH + NaCN ==CH3COONa+ HCN
C.CO2 + H2O+ 2 NaClO ==Na2CO3+2 HClO
D.NaHCO3 + HCN == NaCN+ H2O+ CO2↑
(3)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb= ____________。(用含a的代数式表示)
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,由图可知滴定时指示剂应选用__________ (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是_________点对应的溶液;
③比较A、C两点中水的电离程度:A ______ C(填“>”、“=”或“<”)。