题目内容
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。
请回答下列问题:
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是________。
(2)A和C按原子个数比1:l形成4原子分子Y.Y的结构式是________。
(3)分子X的电子式是_____________;D可以在液态X中发生类似于与A2C的反应,
写出反应的化学方程式_________________________________ 。
(4)实验证明,熔融的EF3不导电,其原因是__________________________。
(5)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以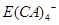 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
(6)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
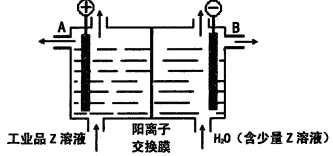
①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH_________________(“增大”、“减小”或”不变”)。
③除去杂质后的Z溶液从液体出口___________________(填写“A”或“B”)导出。
请回答下列问题:
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是________。
(2)A和C按原子个数比1:l形成4原子分子Y.Y的结构式是________。
(3)分子X的电子式是_____________;D可以在液态X中发生类似于与A2C的反应,
写出反应的化学方程式_________________________________ 。
(4)实验证明,熔融的EF3不导电,其原因是__________________________。
(5)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以
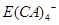 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.(6)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH_________________(“增大”、“减小”或”不变”)。
③除去杂质后的Z溶液从液体出口___________________(填写“A”或“B”)导出。
(1)Na Al Cl N O (1分)
(2)H-O-O-H (1分)
(3)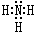 (1分)
(1分)
2Na+2NH3=2NaNH2+H2↑ (2分)
(4)AlCl3 在熔融的状态下不发生电离,没有产生自由移动的离子 (1分)
(5)2Al+2OH-+6H2O=2Al(OH)4-+3H2↑ (2分)
(6)① 4OH--4e-=2H2O+O2↑ (2分)
②增大 (2分)
③ B (2分)
(2)H-O-O-H (1分)
(3)
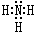 (1分)
(1分)2Na+2NH3=2NaNH2+H2↑ (2分)
(4)AlCl3 在熔融的状态下不发生电离,没有产生自由移动的离子 (1分)
(5)2Al+2OH-+6H2O=2Al(OH)4-+3H2↑ (2分)
(6)① 4OH--4e-=2H2O+O2↑ (2分)
②增大 (2分)
③ B (2分)
A、B、C、D、E为原子序数依次增大的短周期元素,其中A原子半径最小,则A为氢元素;A和B可形成4原子10电子的分子X,故B为N元素;C的最外层电子数是内层的3倍;,故 C为O元素;D原子的最外层电子数是最内层电子数的一半,故 D为Na元素,E是地壳中含量最多的金属元素,故 E为 Al元素,F元素的最高正价与最低负价代数和为6,故 F为 Cl元素
⑴同周期自左而右原子半径减小,故原子半径N>O,Na >Al >Cl ,B、C、D、E、F五种元素原子半径由大到小的顺序是Na Al Cl N O,答案:Na Al Cl N O;
⑵A和C按原子个数比1:l形成4原子分子Y,Y为H2O2,结构式是H-O-O-H ,答案:H-O-O-H ;
⑶分子X为NH3,NH3的电子式是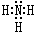 ,Na与液氨反应的方程式为:2Na+2NH3=2NaNH2+H2↑ ,答案:
,Na与液氨反应的方程式为:2Na+2NH3=2NaNH2+H2↑ ,答案: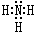 ,2Na+2NH3=2NaNH2+H2↑ ;
,2Na+2NH3=2NaNH2+H2↑ ;
⑷AlCl3是共价化合物,在熔化状态时不能电离,没有产生自由移动的离子,故不能导电,答案;AlCl3 在熔融的状态下不发生电离,没有产生自由移动的离子;
⑸E是Al,Al的单质可溶于A、C、D形成的化合物Z是NaOH的水溶液中。生成阴离子是[Al(OH)4]―,离子方程式为 :2Al+2OH-+6H2O=2Al(OH)4-+3H2↑ ,答案:2Al+2OH-+6H2O=2Al(OH)4-+3H2↑ ;
⑹①电解NaOH溶液,实际上是电解水,阳极:4OH--4e-=2H2O+O2↑,②阴极:4H2O+4e-=2H2+4OH― , 阴极pH增大;③由②可知,B处可以获得溶液较高的NaOH溶液;答案:① 4OH--4e-=2H2O+O2↑②增大③ B
⑴同周期自左而右原子半径减小,故原子半径N>O,Na >Al >Cl ,B、C、D、E、F五种元素原子半径由大到小的顺序是Na Al Cl N O,答案:Na Al Cl N O;
⑵A和C按原子个数比1:l形成4原子分子Y,Y为H2O2,结构式是H-O-O-H ,答案:H-O-O-H ;
⑶分子X为NH3,NH3的电子式是
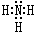 ,Na与液氨反应的方程式为:2Na+2NH3=2NaNH2+H2↑ ,答案:
,Na与液氨反应的方程式为:2Na+2NH3=2NaNH2+H2↑ ,答案: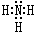 ,2Na+2NH3=2NaNH2+H2↑ ;
,2Na+2NH3=2NaNH2+H2↑ ;⑷AlCl3是共价化合物,在熔化状态时不能电离,没有产生自由移动的离子,故不能导电,答案;AlCl3 在熔融的状态下不发生电离,没有产生自由移动的离子;
⑸E是Al,Al的单质可溶于A、C、D形成的化合物Z是NaOH的水溶液中。生成阴离子是[Al(OH)4]―,离子方程式为 :2Al+2OH-+6H2O=2Al(OH)4-+3H2↑ ,答案:2Al+2OH-+6H2O=2Al(OH)4-+3H2↑ ;
⑹①电解NaOH溶液,实际上是电解水,阳极:4OH--4e-=2H2O+O2↑,②阴极:4H2O+4e-=2H2+4OH― , 阴极pH增大;③由②可知,B处可以获得溶液较高的NaOH溶液;答案:① 4OH--4e-=2H2O+O2↑②增大③ B

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 I研究G蛋白偶联受体,下列说法正确的是
I研究G蛋白偶联受体,下列说法正确的是