题目内容
下面是某化学学习小组通过实验探究来学习“铁的三种价态之间的转化”的案例.(1)材料及试剂:具支试管、
(2)实验装置
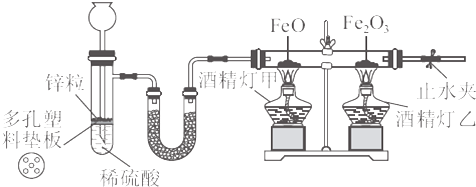
实验前需要检查该装置的气密性,方法是
(3)U形管中装入的药品是
(4)待锌粒与稀硫酸反应一段时间后,再点燃酒精灯甲和酒精灯乙,这样操作的必要性是
(5)实验完毕,关闭止水夹,熄灭两只酒精灯,可以观察到具支试管与长颈漏斗中的现象是
关闭止水夹的目的是
(6)玻璃管冷却后,取出玻璃管内的物质检验有单质铁存在,写出玻璃管内发生反应的化学方程式:
(2)该装置中有长颈漏斗,故可采用注水法检查装置气密性;
(3)铁的氧化物的还原需要干燥的还原性气体,否则水蒸气容易与还原出的铁反应;
(4)反应前装置中有空气,刚通入氢气时便加热,可能会导致爆炸;
(5)熄灭酒精灯,玻璃管内反应结束,关闭止水夹,锌粒与酸仍然反应产生气体,根据装置内气压升高来确定现象;
(6)铁的氧化物被氢气还原,可以得到金属铁和水.
(2)该装置中有长颈漏斗,可采用注水法检查装置气密性:关闭止水夹,在长颈漏斗中注入水,如果漏斗中能够形成一段水柱,且水柱在短时间内不回落,则证明该装置气密性良好,故答案为:关闭止水夹,在长颈漏斗中注入水,如果漏斗中能够形成一段水柱,且水柱在短时间内不回落,则证明该装置气密性良好;
(3)铁的氧化物的还原需要干燥的还原性气体,否则水蒸气容易与还原出的铁反应,故U形管中是干燥剂,可以选择碱石灰(或无水氯化钙),故答案为:碱石灰(或无水氯化钙);除去氢气中的水蒸气(或答“干燥氢气”);
(4)反应前装置中有空气,若刚通入氢气时便加热,可能会导致爆炸,故采用先通入氢气排出空气然后再加热的方法排出装置体系中的空气,防止爆炸,故答案为:排出装置体系中的空气,防止爆炸;
(5)熄灭酒精灯,玻璃管内反应结束,关闭止水夹,因为锌粒与酸仍然反应产生气体,使装置内气压升高,具支试管中的液体被压入长颈漏斗中,故答案为:具支试管中的液面下降,长颈漏斗中的液面上升;防止被还原出的铁再被氧化;
(6)铁的氧化物被氢气还原,可以得到金属铁和水,即FeO+H2
| ||
| ||
| ||
| ||

 阅读快车系列答案
阅读快车系列答案【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)__________________________________;
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】(1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是______________________;证明分解产物中有CO的现象是______________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________。
【交流讨论】小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。_____________________________________________________________________。
【研究课题】 探究草酸晶体受热分解的产物
【查阅资料】 该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)_____________________________________________________。
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】 (1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是___________________________;证明分解产物中有CO的现象是_________________________________________________________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________________
_____________________________________________________________________。
【交流讨论】 小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。
_____________________________________________________________________
_____________________________________________________________________。
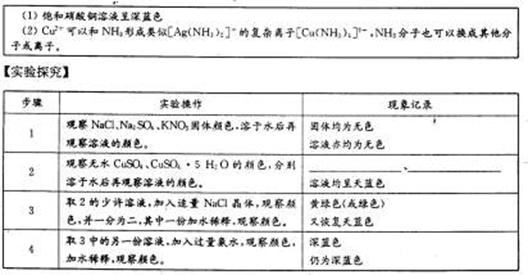 【资料卡片】
【资料卡片】
