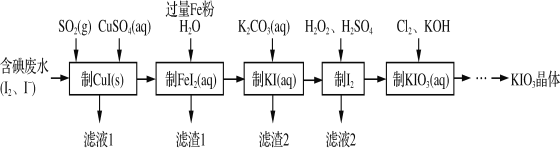
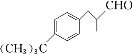
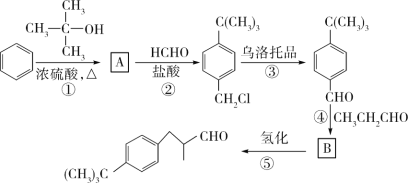
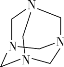
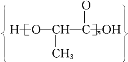
题目内容
【题目】一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是
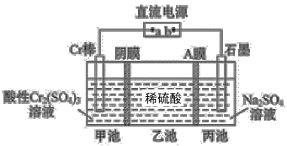
A.b为直流电源的负极
B.阴极反应式为2H++2e-=H2↑
C.工作时,乙池中溶液的pH减小
D.若有1mol离子通过A膜,理论上阳极生成5.6mL气体
【答案】C
【解析】
该装置制备高纯Cr和硫酸,甲池中Cr电极上Cr3+得电子发生还原反应,则Cr为阴极,阴极电极反应式为Cr3++3e-=Cr;阳极电极反应式为2H2O-4e-=O2↑+4H+,从而实现目的,据此分析解答。
A. 该装置制备高纯Cr和硫酸,甲池中Cr电极上Cr3+得电子发生还原反应,则Cr为阴极,连接阴极的电极a为负极,则b为正极,A项错误;
B. 阴极反应式为Cr3++3e-=Cr;阳极反应式为2H2O4e=O2↑+4H+,B项错误;
C. 甲池中硫酸根离子通过交换膜进入乙池、丙中生成的氢离子通过交换膜进入乙池,所以导致乙池中硫酸浓度增大,溶液的pH减小,C项正确;
D. 若有1 mol离子通过A膜,则丙池生成1mol氢离子,根据氢离子和氧气关系知,理论上阳极生成气体0.25mol,但没有指明为标准状况,不能计算氧气的体积,D项错误;
答案选C。

【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
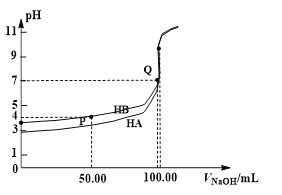
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。