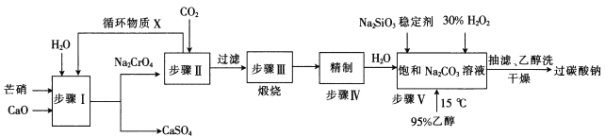
题目内容
【题目】在2 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为______________(填“吸热”或“放热”)反应。
(2)能判断该反应是否达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。该温度下,若向该容器中充入n(CO2)=1 mol,n(H2)=1 mol,4 min末达到平衡,CO2的转化率为_____________,H2的体积分数为_________。
【答案】吸热 BC 830 50% 25%
【解析】
(1)根据温度对化学平衡、化学平衡常数的影响结合表格数据分析判断;
(2)化学平衡状态的标志:正逆反应速率相等,各组分含量保持不变,据此分析判断;
(3)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),说明平衡常数K=1;该温度下,向该容器中充入n(CO2)=1 mol,n(H2)=1 mol,CO2、H2的起始物质的量之比等于化学计量数之比,则二者平衡浓度相等,由CO2(g)+H2(g)CO(g)+H2O(g),可知平衡时CO(g)、H2O(g)浓度相等,结合平衡常数K=![]() =1,分析解答。
=1,分析解答。
(1)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热;
(2)A、该反应是一个反应前后体积不变的反应,容器中的压强始终不变,压强不变不能表示达到平衡状态,故A错误;B、化学平衡时,各组分的浓度不随时间的改变而改变,c(CO)不变能够说明达到平衡状态,故B正确;C、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故C正确;D、c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,故D错误;故选BC;
(3)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),说明平衡常数K=1,故温度为830℃;该温度下,向该容器中充入n(CO2)=1 mol,n(H2)=1 mol,CO2、H2的起始物质的量之比等于化学计量数之比,则二者平衡浓度相等,由CO2(g)+H2(g)CO(g)+H2O(g),可知平衡时CO(g)、H2O(g)浓度相等,结合平衡常数K=![]() =1可知,平衡时c(CO2)=c(H2)=c(CO)=c(H2O),根据碳元素守恒可知,平衡时n(CO2)=n(CO2)=
=1可知,平衡时c(CO2)=c(H2)=c(CO)=c(H2O),根据碳元素守恒可知,平衡时n(CO2)=n(CO2)=![]() =0.5mol,故二氧化碳的转化率为
=0.5mol,故二氧化碳的转化率为![]() ×100%=50%; n(H2)=0.5mol,则H2的体积分数
×100%=50%; n(H2)=0.5mol,则H2的体积分数![]() ×100%=25%,故答案为:830;50%;25%。
×100%=25%,故答案为:830;50%;25%。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】某实验小组研究溶液中AgNO3和Na2S的反应。

(1)用离子方程式解释AgNO3溶液pH<7的原因是____________________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为Ag+和SO42—(Ag2SO4可溶于硝酸);
ii. Ag2O能溶解在浓氨水中形成银氨溶液[Ag(NH2)2OH],而Ag2S和Ag均不能。
①设计并实施如下实验,证实沉淀中含有Ag2S,试剂1和试剂2分别是_________、________。

现象1中出现的现象是_______________________________。
②设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作补充完整。
实验操作 | 实验现象 | |
步骤i | 其少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀, ____________ | 没有沉淀出现 |
写出步骤i中反应的化学方程式:_________________________。
③经检验,沉淀中不含有Ag。
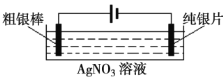
(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如图所示),测得电压为a (a>0)。对AgNO3溶液中氧化S2—的物质进行推测:
假设1:0. 1 mol/L AgNO3溶液(pH=4)中的Ag+氧化了S2—;
假设2:0. 1 mol/L AgNO3溶液(pH=4)中的NO3—氧化了S2—
利用下图装置继续研究(已知:电压大小反映了物质氧化性与还原性强弱的差异;物质氧化性与还原性强弱的差异越大,电压越大)。

①将pH=4的0. 1 mol/L AgNO3溶液替换为_____溶液,记录电压为b(b>0)
②上述实验证实了氧化S2—的物质中一定包含了Ag+,其证据是_________实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。