题目内容
2.下列化学反应对应的离子方程式书写正确的是( )| A. | 硫化钠水解:S2-+2H2O?H2S+2OH- | |
| B. | 向Ba(OH)2溶液中滴加稀H2SO4:H++OH-═H2O | |
| C. | 向CuCl2溶液中加入H2S溶液:Cu2++S2-═CuS↓ | |
| D. | CaCO3溶于稀HCl:CaCO3+2H+═Ca2++CO2↑+H2O |
分析 A.硫离子的水解分步进行,主要以第一步为主;
B.二者反应生成硫酸钡沉淀和水,漏掉了生成硫酸钡沉淀的反应;
C.硫化氢为气体,离子方程式中不能拆开;
D.碳酸钙和稀盐酸反应生成氯化钙、二氧化碳气体和水.
解答 解:A.硫化钠水解生成硫氢根离子和氢氧根离子,正确的离子方程式为:S2-+H2O?HS-+OH-,故A错误;
B.向Ba(OH)2溶液中滴加稀H2SO4,反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2H++2OH-+SO42-=2H2O+BaSO4↓,故B错误;
C.向CuCl2溶液中加入H2S溶液,硫化氢不能拆开,正确的离子方程式为:Cu2++H2S═CuS↓+2H+,故C错误;
D.碳酸钙溶于稀HCl,反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
2.已知反应A(g)+B(g)?2C(g),B为有色气体,反应平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
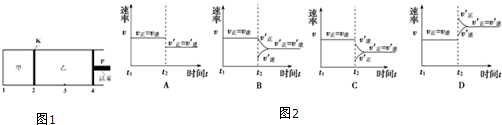
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.
| 温度T (℃) | 600 | 800 | 900 | 1000 | 1200 |
| 平衡常数 K | 7.2 | 4.8 | 4.0 | 2.4 | 0.16 |
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.

3.下列得到的四种溶液的溶质质量分数最大和最小的分别是( )
①7.5g胆矾溶于100g水中;
②5.1g Ca(OH)2放入100g水中;
③向50g 8%的NaOH溶液中加入50g水;
④已知20℃时KMnO4 的溶解度为6.4g,用100g水,在20℃时配成KMnO4 的饱和溶液.
①7.5g胆矾溶于100g水中;
②5.1g Ca(OH)2放入100g水中;
③向50g 8%的NaOH溶液中加入50g水;
④已知20℃时KMnO4 的溶解度为6.4g,用100g水,在20℃时配成KMnO4 的饱和溶液.
| A. | ④、③ | B. | ④、② | C. | ①、② | D. | ③、① |
10.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如下:

已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低.
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).
17.下列有关化学实验的操作方法或结论的叙述正确的是( )
| A. | 用铁片与硫酸反应制取氢气时,用98%的硫酸可以加快产生氢气的速率 | |
| B. | 向氯水中加入少量的AgNO3溶液,可使氯气与水反应的平衡向逆反应方向移动 | |
| C. | 洁净的酸(或碱)式滴定管在加入酸(或碱)溶液之前,要用所要盛装的酸(或碱)溶液润洗2-3次 | |
| D. | 常温下,向饱和硫酸钙溶液中加入碳酸钠溶液一定会有沉淀生成 |
7.从绿色化学和经济效益角度考虑,制取Cu(NO3)2最适宜采用的方法是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu$\stackrel{空气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
11.下列化学用语正确的是( )
| A. | F-的结构示意图: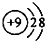 | B. | 乙烯分子比例模型: | ||
| C. | 乙酸的结构式:C2H4O2 | D. | Na2O的电子式: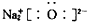 |
12.下列各组物质的关系描述正确的是( )
| A. | H2O与D2O属同系物 | |
| B. | 35Cl与37Cl属同素异形体 | |
| C. | O2与O3属同位素 | |
| D. | 乙醇与二甲醚(CH3-O-CH3)属同分异构体 |
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题: