题目内容
某温度、压强下,将一定量反应物通入密闭容器进行反应:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH =" +Q" kJ·mol-1(Q>0),下列叙述正确的是
Si(s)+4HCl(g);ΔH =" +Q" kJ·mol-1(Q>0),下列叙述正确的是
SiCl4(g)+2H2(g)
 Si(s)+4HCl(g);ΔH =" +Q" kJ·mol-1(Q>0),下列叙述正确的是
Si(s)+4HCl(g);ΔH =" +Q" kJ·mol-1(Q>0),下列叙述正确的是 | A.反应过程中,若增大压强,能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态 |
| D.使用过量的H2或升高温度都可以提高SiCl4的转化率 |
D
试题分析:A、从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B、该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C、正、逆反应速率不等,故错。
故选D。
点评:本题考查较为综合,涉及反应热的计算、化学反应速率、化学平衡等问题,题目难度中等,注意反应的可逆性。

练习册系列答案
相关题目

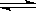 2NH3 △H<0。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=3Q1,则甲容器中,H2的转化率为
2NH3 △H<0。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=3Q1,则甲容器中,H2的转化率为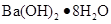 与
与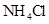 的反应
的反应
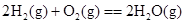



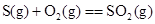
 2CO(g);
2CO(g);