题目内容
【题目】Ⅰ.某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如下图所示的实验装置。
|
|
|
|
A | B | C | D |
(1)为验证上述气体,将混合气体依次通过所用仪器,其顺序为:混合气体→_____→ A →_____→_____(每种仪器只能使用一次)
(2)A中品红溶液的作用是__________________________。
(3)确定有CO2生成的实验现象是____________________________________________。
(4)在不影响实验检验结果的情况下,理论上B中的高锰酸钾溶液还可以用下列哪些试剂代替_____________
①饱和NaHCO3溶液 ②浓硫酸 ③氯水 ④H2S溶液 ⑤Na2SO3溶液
Ⅱ.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
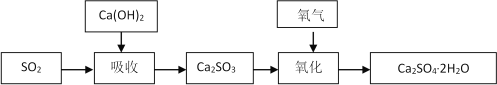
石灰-石膏法的吸收反应为SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
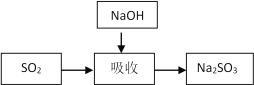
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(1)石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 ____________________ 。和碱法相比,石灰-石膏法的优点是 ________________ ,缺点是 ________________ 。
(2)某学习小组在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是__________________、___________________、___________________(填化学式)

【答案】 混合气体→ D → A → B → C 检验气体中的二氧化硫 B中高锰酸钾未溶液完全褪色,C中变混浊。 ③ 酸性氧化物与碱的反应 原料便宜,成本低 吸收慢,效率低 NaOH Ca(OH)2 Na2SO3
【解析】Ⅰ.(1)反应后所得混合气体中混有CO2、SO2及H2O(g),应依次检验H2O(g)、SO2、CO2,将混合气体依次通过所用仪器,其顺序为:混合气体→D→ A →B→C;
(2)A中品红溶液的作用是检验气体中的二氧化硫;
(3)确定有CO2生成,首先要排除SO2的干扰,则观察到的实验现象是B中高锰酸钾未溶液完全褪色,C中变混浊;
(4)酸性高锰酸钾的作用是吸收SO2,同时确保SO2已经完全除去,则可选择的试剂应有较强氧化性,且实验过程中要有颜色变化,便于观察实验现象,故可以用氯水代替,答案为③;Ⅱ.(1)灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等;由于吸收产物亚硫酸钙由管道输送至氧化塔氧化,所以缺点为亚硫酸钙在输送中容易造成管道堵塞,导致吸收速率慢、效率低,
(2)将亚硫酸钠和氢氧化钙发生复分解反应生成NaOH,然后再将亚硫钙氧化得到二水硫酸钙,这样NaOH能循环利用,涉及反应为:SO2+2NaOH═Na2SO3+H2O,Na2SO3+Ca(OH)2═CaSO3+2NaOH,2CaSO3+O2=2CaSO4,则甲为NaOH、乙为Ca(OH)2、丙为Ns2SO3。

【题目】化学在生活中有着广泛的应用,下列对立关系正确的是
选项 | 化学性质 | 实际应用 |
A | SO2具有还原性 | 漂白纸浆 |
B | HF具有弱酸性 | 在玻璃上刻字, |
C | 铝的金属活动性强于氢 | 用铝制容器贮运浓硝酸 |
D | FeCl3溶液能与Cu反应 | 蚀刻铜箔制造电路板 |
A. A B. B C. C D. D
【题目】利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4 H2O 的实验流程如下:

已知:25℃时,几种硫化物的溶度积常数如下:
物质 | FeS | MnS | HgS |
溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 2.7 | 7.6 | 8.3 |
完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有______________。
(2)在加热条件下“浸取”,其原因是__________________;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为__________________________。
(3)滤渣I的成分为MnO2、C和____________(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的c(Hg2+)/C(Fe2+)= ____________(填数值)。
(4)“氧化”时的离子方程式为____________;氧化时可用H2O2代替MnO2,H2O2的电子式为_______。
(5)中和时,应该调节溶液pH的范围到____________。