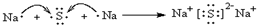题目内容
17.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )| A. | X与Y形成化合物时,X可以显负价,Y显正价 | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 第一电离能可能Y小于X | |
| D. | 最高价含氧酸的酸性:X对应的酸的酸性弱于Y对应的酸的酸性 |
分析 A.电负性越大,对键合电子吸引力越强,在化合物中表现负价;
B.电负性越大,非金属性越强,气态氢化物越稳定;
C.电负性大的元素,其第一电离能不一定,原子核外电子处于半满、全满等稳定状态时,能量较低,第一电离能高于同周期相邻元素;
D.电负性越大,非金属性越强,其最高价氧化物的水化物的酸性越强(但O、F除外).
解答 解:A.电负性X>Y,X对键合电子吸引力越强,在化合物中X表现负价,Y表现正价,故A正确;
B.电负性X>Y,则非金属性X>Y,非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY小于HnX,故B正确;
C.电负性大的元素,其第一电离能不一定,原子核外电子处于半满、全满等稳定状态时,能量较低,第一电离能高于同周期相邻元素,如第一电离能N>O,故C正确;
D.电负性X>Y,则非金属性X>Y,若存在最高价含氧酸,X对应的最高价含氧酸的酸性强于Y对应的最高价含氧酸的酸性,故D错误,
故选D.
点评 本题考查位置结构性质关系应用,侧重对元素周期律的考查,注意理解同周期第一电离能异常原因.

练习册系列答案
相关题目
7.下列各表中的数字代表的是元素的原子序数,表中数字所表示的元素与它们在周期表中的相对位置相符的是( )
| A. |
| B. |
| C. |
| D. |
|
8.不同元素的原子(包括离子)( )
| A. | 质子数一定不等 | B. | 中子数一定不等 | ||
| C. | 质量数一定不等 | D. | 核外电子数一定不等 |
9.对下列装置作用的分析或解释正确的是( )
| A. | 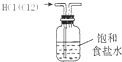 装置可除去HCl中的Cl2杂质 | |
| B. | 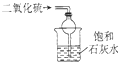 装置可吸收SO2,并防止倒吸 | |
| C. | 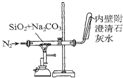 装置石灰水变浑浊即可证明非金属性:Si>C | |
| D. |  装置可制取并收集NO气体 |
6.下列气态氢化物中最稳定的是( )
| A. | PH3 | B. | H2S | C. | HCl | D. | HBr |
7.有机化学主要研究有机化合物所发生的反应,下列化合物中不是有机物的是( )
| A. | NaHCO3 | B. | C2H6 | C. | HCHO | D. | CH3OH |
 .
. .
. .元素D在元素周期表中的位置是第三周期第VIIA族.
.元素D在元素周期表中的位置是第三周期第VIIA族.

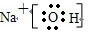 NH4Cl:
NH4Cl: CO2:
CO2: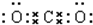 HClO:
HClO: NH3:
NH3: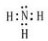 .
.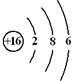 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程