题目内容
7.下列各表中的数字代表的是元素的原子序数,表中数字所表示的元素与它们在周期表中的相对位置相符的是( )| A. |
| B. |
| C. |
| D. |
|
分析 相邻两个周期同主族元素的原子序数相差2、8、18、32,以此判断同族中位置关系,同周期元素根据原子序数判断位置关系,注意第ⅡA族、第ⅢA族之间有10个空列为7个副族和1个Ⅷ族,以此来解答.
解答 解:A.原子序数为8的元素为O,原子序数为10的元素为Ne,原子序数为17的元素为Cl,原子序数为36的元素为Kr,符合元素在周期表的位置关系,故A选;
B.原子序数为1的元素为H,原子序数为4的元素为Be,二者在周期表中的族不相邻,故B不选;
C.原子序数为1、11、19的元素均位于第IA族,但原子序数为1的元素为H,与原子序数为2的元素为He,中间相隔17个纵行,故C不选;
D.原子序数为6的元素为C,原子序数为10的元素为Ne,原子序数为17的元素为Cl,原子序数为36的元素为Kr,但C与Cl不位于相邻主族,故D不选;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,注意运用原子序数推导元素在周期表中的位置关系,题目难度中等,注意在周期表中相邻位置的判断.

练习册系列答案
相关题目
17.随着环保意识增强,清洁能源越来越受到人们关注.甲烷是一种较为理想的洁净燃料.以下是利用化学反应原理中的有关知识对甲烷转化问题的研究.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
表中t=480,p=303;设计实验2、3的目的是探究温度对化学反应速率的影响.实验1、2、3中反应的化学平衡常数的大小关系是K2>K1=K3(用K1、K2、K3表示).
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
则此时正、逆反应速率的关系是C(填标号)
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
18.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: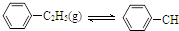 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
经一段时间后达到平衡.反应过程中测定的部分数据见下表:
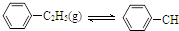 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )经一段时间后达到平衡.反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
15.已知苯跟一卤代烷在催化剂作用下可生成苯的同系物.如: 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3-CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
2.市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强.衣物上的汗渍、血迹及人体排放的蛋白质污渍遇到它,皆能水解而被除去.下列衣料中不能用加酶洗衣粉洗涤的是:①棉织品 ②蚕丝织品 ③毛织品( )
| A. | ① | B. | ②③ | C. | ①②③ | D. | ①③ |
12.洁净的空气是人类高品质生活的基础.空气质量日报中不包含的内容是( )
| A. | 一氧化碳 | B. | 二氧化硫 | C. | 二氧化碳 | D. | PM2.5 |
19.许多物质都有俗称.以下物质的俗称与化学式不相符的是( )
| A. | 干冰CO2 | B. | 生石灰CaO | C. | 熟石灰Ca(OH)2 | D. | 纯碱NaOH |
16.某化学兴趣小组的同学们将稀硫酸逐渐加入氢氧化铜固体中,至氢氧化铜恰好完全溶解.
(1)该反应的化学方程式是Cu(OH)2+H2SO4═CuSO4+2H2O.
(2)兴趣小组的同学们欲利用上述反应后的剩余溶液探究中和反应的微观本质.
【猜想与假设】
猜想①:中和反应的微观本质是金属阳离子(铜离子)与酸根离子(硫酸根离子)结合生成盐(硫酸铜).
猜想②:中和反应的微观本质是另外两种离子即氢离子和氢氧根离子结合生成了水.
【实验验证】
【反思与评价】
小亮认为不用进行方案l即可直接判断猜想①,理由是稀硫酸与氢氧化铜反应后的溶液呈蓝色,说明铜离子并没有被结合.
(1)该反应的化学方程式是Cu(OH)2+H2SO4═CuSO4+2H2O.
(2)兴趣小组的同学们欲利用上述反应后的剩余溶液探究中和反应的微观本质.
【猜想与假设】
猜想①:中和反应的微观本质是金属阳离子(铜离子)与酸根离子(硫酸根离子)结合生成盐(硫酸铜).
猜想②:中和反应的微观本质是另外两种离子即氢离子和氢氧根离子结合生成了水.
【实验验证】
| 方案 | 实验步骤 | 实验现象 | 结论 | 有关反应的化学方程式 |
| 1 | 取少量待测溶液,向其中滴加适量BaCl2溶液 | |||
| 2 | 猜想②正确 | 无 |
小亮认为不用进行方案l即可直接判断猜想①,理由是稀硫酸与氢氧化铜反应后的溶液呈蓝色,说明铜离子并没有被结合.
17.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A. | X与Y形成化合物时,X可以显负价,Y显正价 | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 第一电离能可能Y小于X | |
| D. | 最高价含氧酸的酸性:X对应的酸的酸性弱于Y对应的酸的酸性 |