题目内容
3.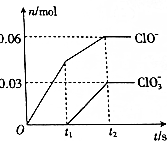 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )| A. | Cl2和苛性钾溶液在不同温度下可能发生不同反应 | |
| B. | t1时刻,c(Cl-):c(ClO-)=5:1 | |
| C. | 原苛性钾溶液中KOH的物质的量为0.3mol | |
| D. | t2时刻,n(还原产物):n(氧化产物)=7:3 |
分析 由图可知,t2时,n(ClO-)=0.06mol,n(ClO3-)=0.03mol,t1时溶液中不存在ClO3-,由电子守恒可知,Cl元素得到电子转化为Cl-,由电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=转移电子物质的量,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-);t2时刻生成ClO-和ClO3-的物质的量分别为0.06mol、0.03mol,失去电子为0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,则得到电子应为0.21mol,据此回答.
解答 解:A.由图可知,t2时,n(ClO-)=0.06mol,n(ClO3-)=0.03mol,t1时溶液中不存在ClO3-,则Cl2和苛性钾溶液在不同温度下可能发生不同反应,故A正确;
B.0~t1时,氢氧化钾与氯气反应生成氯化钾、次氯酸钾和水,根据电子守恒,所以c(Cl-):c(ClO-)=1:1故B错误;
C.物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,故C正确;
D.由图可知,t2时刻生成ClO-和ClO3-的物质的量分别为0.06mol、0.03mol,失去电子为0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,
由电子守恒可知得到电子应为0.21mol,则Cl-的物质的量为$\frac{0.21mol}{0-(-1)}$=0.21mol,氧化产物为NaClO和NaClO3,还原产物为NaCl,则t2时刻,n(还原产物):n(氧化产物)为0.21mol:0.09mol=7:3,故D正确;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,注意图中只体现Cl元素的化合价升高,把握电子守恒、物料守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 金博士一点全通系列答案
金博士一点全通系列答案| A. | 水导电性很差,所以水不是电解质 | |
| B. | 判断某化合物是否为电解质,应看其在一定条件下能否电离 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都不是电解质 | |
| D. | NaCl和HCl都是电解质,所以它们熔融状态下都能导电 |
| A. | 常温常压下,3.2gO2所含的原子数为0.2NA | |
| B. | 标准状况下,18gH2O所含的氧原子数目为NA | |
| C. | 常温常压下,92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
| A. | 测得0.1mol/L HA的pH>l | |
| B. | 测得NaA溶液的pH>7 | |
| C. | pH=l的HA溶液与盐酸稀释100倍后,盐酸的pH变化大 | |
| D. | 足量锌与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多 |
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 |
(2)向沉淀X中加入NaOH溶液,有关反应的化学方程式为NaOH+Al(OH)3=NaAlO2+2H2O,过滤后将所得沉淀加热后得红棕色固体,写出高温下该固体与金属铝的反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)一定条件下电解含Mn2+的溶液可以制得MnO2,生成MnO2的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,同时在另一极还能获得一种清洁能源是H2.
| A. | 原条件下KCl的溶解度小于ω1g | B. | m1•ω1%-m=m2•ω2% | ||
| C. | ω1一定大于ω2 | D. | m1-m2≤m |
| A. | 它是一种阳离子 | B. | 该离子所含质子总数比电子总数多 | ||
| C. | 一个N5+离子中有36个质子 | D. | N5+离子中含有34个电子 |


 .
. .
. (或
(或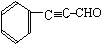 ).
). 、
、 、
、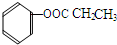 、
、 、
、 、
、 (写结构简式).
(写结构简式).