ЬтФПФкШн
ЁОЬтФПЁПЧыШЯецЙлВьЭМЃЌШЛКѓЛиД№ЮЪЬтЃК

ЃЈ1ЃЉЭМжаЫљЪОЗДгІЪЧ___(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІ
ЃЈ2ЃЉЭМжаЫљЪОЗДгІЕФІЄH=___(гУКЌE1ЁЂE2ЕФДњЪ§ЪНБэЪО)ЁЃ
ЃЈ3ЃЉЯТСа4ИіЗДгІжаЃЌЗћКЯЪОвтЭМУшЪіЕФЗДгІЕФЪЧ____(ЬюДњКХ)ЁЃ
AЃЎбЮЫсгыNaOHЗДгІ BЃЎNaгыH2OЗДгІЩњГЩH2
CЃЎТСШШЗДгІ DЃЎзЦШШЕФЬПгыЫЎеєЦјЗДгІЩњГЩCOКЭH2
ЃЈ4ЃЉвдМзЭщЮЊдСЯжЦШЁЧтЦјЪЧЙЄвЕЩЯГЃгУЕФжЦЧтЗНЗЈЁЃвбжЊЃК
CH4(g)ЃЋH2O(g)=CO(g)ЃЋ3H2(g) ІЄHЃН+206.2kJ/mol
CH4(g)ЃЋCO2(g)=2CO(g)ЃЋ2H2(g) ІЄHЃН+247.4kJ/mol
CH4(g)гыH2O(g)ЗДгІЩњГЩCO2(g)КЭH2(g)ЕФШШЛЏбЇЗНГЬЪНЮЊЃК___ЁЃ
ЁОД№АИЁПЗХШШ ЃЈE2 - E1ЃЉkJ/mol ABC CH4(g) +2H2O(g)=CO2(g)+4H2(g) ІЄH=+165.0kJ/mol
ЁОНтЮіЁП
ИљОнЭМЯёЗжЮіЗДгІЮяФмСПКЭЩњГЩЮяФмСПЙиЯЕЃЌМЦЫуьЪБфЕШгкЩњГЩЮязмФмСПМѕШЅЗДгІЮязмФмСПЃЌдйИљОнГЃМћЕФЗХШШЗДгІЙцТЩЗжЮіФФаЉЗДгІЪєгкЗХШШЗДгІЃЌРћгУИЧЫЙЖЈТЩЧѓФПБъЗДгІЗНГЬЪНЕФШШЛЏбЇЗНГЬЪНЁЃ
ЂХЭМжааХЯЂПЩжЊЗДгІЮязмФмСПИпгкЩњГЩЮязмФмСПЃЌвђДЫЮЊЗХШШЗДгІЃЌЙЪД№АИЮЊЃКЗХШШЃЛ
ЂЦьЪБфЕШгкЩњГЩЮязмФмСПМѕШЅЗДгІЮязмФмСПЃЌвђДЫЭМжаЫљЪОЗДгІЕФІЄH=ЃЈE2 - E1ЃЉkJ/molЃЌЙЪД№АИЮЊЃКЃЈE2 - E1ЃЉkJ/molЃЛ
ЂЧAбЁЯюЃЌбЮЫсгыNaOHЗДгІЪЧЗХШШЗДгІЃЌЗћКЯЬтвтЃЌ
BбЁЯюЃЌNaгыH2OЗДгІЩњГЩH2ЪЧЗХШШЗДгІЃЌЗћКЯЬтвтЃЌ
CбЁЯюЃЌТСШШЗДгІЪЧЗХШШЗДгІЃЌЗћКЯЬтвтЃЌ
DбЁЯюЃЌзЦШШЕФЬПгыЫЎеєЦјЗДгІЩњГЩCOКЭH2ЪЧЮќШШЗДгІЃЌВЛЗћКЯЬтвтЃЌЙЪABCе§ШЗЃЛ
злЩЯЫљЪіЃЌД№АИЮЊABCЃЛ
ЂШCH4(g)ЃЋH2O(g)=CO(g)ЃЋ3H2(g) ІЄHЃН+206.2kJ/mol
CH4(g)ЃЋCO2(g)=2CO(g)ЃЋ2H2(g) ІЄHЃН+247.4kJ/mol
НЋЕквЛИіЗНГЬЪНГЫвд2МѕШЅЕкЖўИіЗНГЬЪНЃЌЕУГіCH4(g)гыH2O(g)ЗДгІЩњГЩCO2(g)КЭH2(g)ЕФШШЛЏбЇЗНГЬЪНЮЊЃКCH4(g) +2H2O(g)=CO2(g)+4H2(g) ІЄH=+165.0kJ/molЃЌЙЪД№АИЮЊCH4(g) +2H2O(g)=CO2(g)+4H2(g) ІЄH=+165.0kJ/molЃЛ

ЁОЬтФПЁПЦћГЕЮВЦјжаКЌгаCOЁЂNOЕШгаКІЦјЬхЁЃ
ЃЈ1ЃЉЦћГЕЮВЦјжаNOЩњГЩЙ§ГЬЕФФмСПБфЛЏШчЭМЪОЁЃ1molN2КЭ1molO2ЭъШЋЗДгІЩњГЩNOЛс____ЃЈЬюЁАЮќЪеЁБЛђЁАЗХГіЁБЃЉ____kJФмСПЁЃ

ЃЈ2ЃЉЭЈЙ§NOДЋИаЦїПЩМрВтЦћГЕЮВЦјжаNOЕФКЌСПЃЌЦфЙЄзїдРэШчЭМЫљЪОЃКЃЈЬсЪОЃКO2-ПЩдкДЫЙЬЬхЕчНтжЪжаздгЩвЦЖЏЃЉ

ЂйNiOЕчМЋЩЯЗЂЩњЕФЪЧ___________ЗДгІЃЈЬюЁАбѕЛЏЁБЛђЁАЛЙдЁБЃЉЁЃ
ЂкЭтЕчТЗжаЃЌЕчзгЪЧДг_________ЕчМЋСїГіЃЈЬюЁАNiOЁБЛђЁАPtЁБЃЉЃЎ
ЂлPtЕчМЋЩЯЕФЕчМЋЗДгІЪНЮЊ________________________ЁЃ
ЃЈ3ЃЉвЛжжаТаЭДпЛЏМСгУгкNOКЭCOЕФЗДгІЃК2NO+2CO![]() 2CO2+N2ЁЃвбжЊдіДѓДпЛЏМСЕФБШБэУцЛ§ПЩЬсИпИУЗДгІЫйТЪЃЌЮЊСЫбщжЄЮТЖШЁЂДпЛЏМСЕФБШБэУцЛ§ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЙцТЩЃЌФГЭЌбЇЩшМЦСЫШ§зщЪЕбщЃЌВПЗжЬѕМўвбОЬюдкЯТБэжаЁЃ
2CO2+N2ЁЃвбжЊдіДѓДпЛЏМСЕФБШБэУцЛ§ПЩЬсИпИУЗДгІЫйТЪЃЌЮЊСЫбщжЄЮТЖШЁЂДпЛЏМСЕФБШБэУцЛ§ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЙцТЩЃЌФГЭЌбЇЩшМЦСЫШ§зщЪЕбщЃЌВПЗжЬѕМўвбОЬюдкЯТБэжаЁЃ
ЪЕбщБрКХ | tЃЈЁцЃЉ | NOГѕЪМХЈЖШ ЃЈmol/LЃЉ | COГѕЪМХЈЖШЃЈmol/LЃЉ | ДпЛЏМСЕФБШБэУцЛ§ЃЈm2/gЃЉ |
Ђё | 280 | 1.2ЁС10Љ3 | 5.80ЁС10Љ3 | 82 |
Ђђ | 280 | 1.2ЁС10Љ3 | b | 124 |
Ђѓ | 350 | a | 5.80ЁС10Љ3 | 82 |
ЂйЧыНЋБэжаЪ§ОнВЙГфЭъећЃКa ___________ЁЃ
ЂкФмбщжЄЮТЖШЖдЛЏбЇЗДгІЫйТЪЙцТЩЕФЪЧЪЕбщ____________ЃЈЬюЪЕбщађКХЃЉЁЃ
ЂлЪЕбщЂёКЭЪЕбщЂђжаЃЌNOЕФЮяжЪЕФСПХЈЖШcЃЈNOЃЉЫцЪБМфtЕФБфЛЏЧњЯпШчЭМЫљЪОЃЌЦфжаБэЪОЪЕбщЂђЕФЪЧЧњЯп_______ЃЈЬюЁАМзЁБЛђЁАввЁБЃЉЁЃ
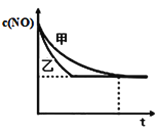
ЃЈ4ЃЉдкШнЛ§ЙЬЖЈЕФОјШШШнЦїжаЗЂЩњЗДгІ2NO+2CO![]() 2CO2+N2ЃЌВЛФмЫЕУївбДяЕНЦНКтзДЬЌЕФЪЧ________ЃЈВЛЖЈЯюбЁдёЃЉЃЛ
2CO2+N2ЃЌВЛФмЫЕУївбДяЕНЦНКтзДЬЌЕФЪЧ________ЃЈВЛЖЈЯюбЁдёЃЉЃЛ
AЃЎШнЦїФкЛьКЯЦјЬхЮТЖШВЛдйБфЛЏ BЃЎШнЦїФкЕФЦјЬхбЙЧПБЃГжВЛБф
CЃЎ2ІдФц(NO)=Іде§(N2) DЃЎШнЦїФкЛьКЯЦјЬхУмЖШБЃГжВЛБф