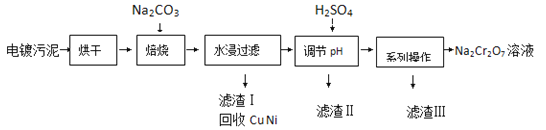
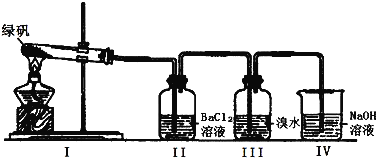
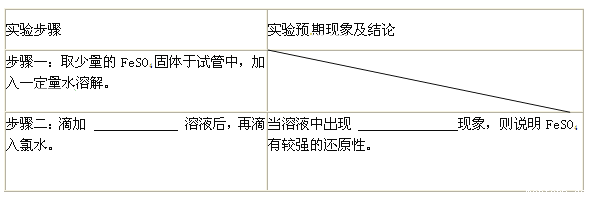
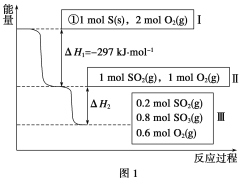
题目内容
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2-与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广。请回答下列问题:
(1)W元素在元素周期表中的位置为 。
(2)下列说法正确的是( )
A.原子半径:A<B<C<D<E
B.D2WC4可以用来做消毒剂和净水剂
C.A4B2C3中既含有离子键又含有共价键
D.D2C2与EC2可以反应生成D2EC3和C2
(3)灼热的碳能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为 。
(4)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为 ;一段时间后,溶液中有大量气泡出现,随后溶液温度升高,有红褐色沉淀生成,则产生气泡的原因是 ;生成沉淀的原因是 (用平衡移动原理解释)。
【答案】(1)第四周期 Ⅷ族;(2)BC;
(3)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(4)H2O2+2H++2FE2+=2FE3++2H2O,FE3+催化H2O2分解产生O2,温度升高,促进FE3+水解平衡向正向移动。
【解析】试题分析:A和D属于同主族,可形成DA型离子化合物,此化合物是NaH,即A为H,D为Na,E2-与Ar原子具有相同的电子层结构,即E为S,C与E同主族,即C为O,B与C同周期且相邻,即B为N,W的合金用量最大,与用途最广,即W为FE,(1)铁26号元素,位于第四周期第Ⅷ族;(2)A、半径大小比较:一看电子层数,电子层数越多,半径越大,二看原子序数,电子层数相同,半径随着原子序数的增大而减小,即Na>S>N>O>H,故错误;B、此化合物是Na2FEO4,FEO42-具有强氧化性,能消毒,FE元素被还原成FE3+,FE3+水解成氢氧化铁胶体,能吸附水中悬浮杂质,达到净水的目的,故正确;C、化学式为H4N2O3,为NH4NO3,属于离子化合物,含有离子键,N和H之间、N和O之间含有共价键,故正确;D、D2C2为Na2O2、EC2为SO2,过氧化钠具有强氧化性,发生Na2O2+SO2=Na2SO4,故错误;(3)C和浓硝酸发生反应:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;(4)A2C2为H2O2,WEC4为FESO4,过氧化氢具有强氧化性,能把FE2+氧化成FE3+,且FE3+作催化剂,使H2O2分解,反应是:H2O2+2H++2FE2+=2FE3++2H2O,FE3+催化H2O2分解产生O2,FE3++3H2O
CO2↑+4NO2↑+2H2O;(4)A2C2为H2O2,WEC4为FESO4,过氧化氢具有强氧化性,能把FE2+氧化成FE3+,且FE3+作催化剂,使H2O2分解,反应是:H2O2+2H++2FE2+=2FE3++2H2O,FE3+催化H2O2分解产生O2,FE3++3H2O![]() FE(OH)3+3H+,水解反应是吸热反应,升高温度使平衡向正反应方向移动,生成红褐色沉淀氢氧化铁。
FE(OH)3+3H+,水解反应是吸热反应,升高温度使平衡向正反应方向移动,生成红褐色沉淀氢氧化铁。

 名校课堂系列答案
名校课堂系列答案