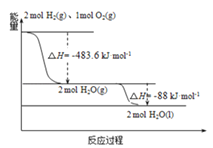
��Ŀ����
����Ŀ����������к���Cr��OH��3��Al2O3��ZnO��CuO��NiO�����ʣ���ҵ��ͨ���������̻���Na2Cr2O7��������
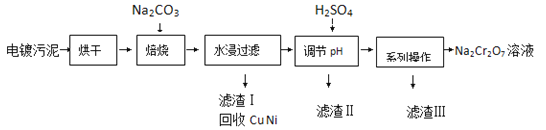
��֪��
��Cr��OH��3��ZnO��Al2O3һ����Ϊ���Ի�������
��Na2Cr2O7��Na2SO4�ڲ�ͬ�¶��µ��ܽ�����±���
20�� | 60�� | 100�� | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
��1�����չ���������Na2CrO4�Ļ�ѧ����ʽΪ ��ˮ������Һ�г�Na2CrO4�����ڵ������� �� ��
��2������H2SO4����pH��Ŀ��Ϊ ��
��3���õ��������ġ�ϵ�в������IJ���Ϊ �� ���ˣ�
��4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g��CrO42����8/9ת��ΪCr2O72������ת����������Һ��c��Cr2O72���� = molL��1��
��5����Na2Cr2O7��H2SO4���Һ�м���H2O2���ټ������Ѳ�ҡ�������Ѳ�Ϊ��ɫ������������CrO5��������Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡���1��4Cr��OH��3+4Na2CO3+3O2![]() 4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2��
4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2��
��2����ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72����
��3������Ũ������ȴ�ᾧ����4��0.2��
��5��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��
��������
�����������1����ʵ��������Na2CrO4�����ݵ������ijɷ��Լ����ϼ۵��������������ķ�Ӧ�ǣ�3O2��4Cr��OH��3��4Na2CO3![]() 4Na2CrO4��4CO2����6H2O��������Ϣ����Al2O3��Na2CO3
4Na2CrO4��4CO2����6H2O��������Ϣ����Al2O3��Na2CO3![]() 2NaAlO2��CO2��ZnO��Na2CO3
2NaAlO2��CO2��ZnO��Na2CO3![]() Na2ZnO2��CO2�����ˮ�������ʺ���NaAlO2��Na2ZnO2����2��ƫ�����ƺ����ᷢ����AlO2����H����H2O=Al��OH��3����Na2ZnO2�����ᷢ����Ӧ��ZnO22����2H��=Zn��OH��2������������ͼ�������CrO42��ת����Cr2O72�����������������ǣ���ȥ��Һ��NaAlO2��Na2ZnO2���ʣ���CrO42��ת����Cr2O72������3�������ظ����ƺ������Ƶ��ܽ�ȣ�ϵ�в���������Ũ������ȴ�ᾧ����4�������������Һ��Crԭ�ӵ����ʵ���Ϊ23.4/52mol=0.45mol����8/9��Crת����Cr2O72������ת����Cr2O72����Cr�����ʵ���Ϊ8��0.45/9mol=0.4mol����Cr2O72�������ʵ���0.4/2mol=0.2mol��c��Cr2O72����=0.2/1mol��L��1=0.2mol��L��1����5��CrO5�к��й���������˴˷�Ӧ����������ԭ��Ӧ����˷�Ӧ����ʽΪ��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��
Na2ZnO2��CO2�����ˮ�������ʺ���NaAlO2��Na2ZnO2����2��ƫ�����ƺ����ᷢ����AlO2����H����H2O=Al��OH��3����Na2ZnO2�����ᷢ����Ӧ��ZnO22����2H��=Zn��OH��2������������ͼ�������CrO42��ת����Cr2O72�����������������ǣ���ȥ��Һ��NaAlO2��Na2ZnO2���ʣ���CrO42��ת����Cr2O72������3�������ظ����ƺ������Ƶ��ܽ�ȣ�ϵ�в���������Ũ������ȴ�ᾧ����4�������������Һ��Crԭ�ӵ����ʵ���Ϊ23.4/52mol=0.45mol����8/9��Crת����Cr2O72������ת����Cr2O72����Cr�����ʵ���Ϊ8��0.45/9mol=0.4mol����Cr2O72�������ʵ���0.4/2mol=0.2mol��c��Cr2O72����=0.2/1mol��L��1=0.2mol��L��1����5��CrO5�к��й���������˴˷�Ӧ����������ԭ��Ӧ����˷�Ӧ����ʽΪ��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��