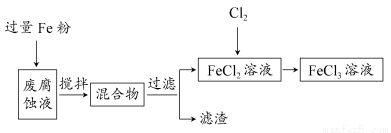
题目内容
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。下列判断不正确的是( )
A.参加反应的硝酸是0.92 mol
B.合金中镁的质量5.9 g
C.反应过程中转移的电子数为0.46 mol
D.合金中含有铜0.092 mol
B
【解析】本题考查硝酸的性质及有关计算,中等难度。由生成NO2和N2O4的体积可得二者物质的量分别为0.4 mol 和0.03 mol,则硝酸得电子的物质的量为0.46 mol,即反应过程中转移的电子为0.46 mol,C正确。设铜和镁的物质的量分别为a和b,则根据电子得失守恒可得2a+2b=0.46 mol,生成沉淀分别为氢氧化铜和氢氧化镁,由质量可得a·98 g/mol+b·58 g/mol=17.02 g,解两个方程式得a=0.092 mol,b=0.138 mol,即合金中含有铜0.092 mol,含有镁0.138 mol,镁的质量为3.312 g,故B错误,D正确。硝酸反应时表现酸性的为0.46 mol,表现氧化性的为0.46 mol,所以参加反应的硝酸是0.92 mol,A正确。解决有关硝酸的计算题要建立守恒的思想,该题中用到了电子守恒和原子守恒。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目