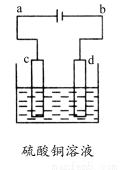
题目内容
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如右图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是( )
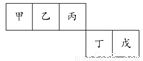
A.最外层电子数:甲>乙>丙>丁>戊
B.简单离子的离子半径:戊>丁
C.含有丁元素的酸有多种
D.乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
C
【解析】第一周期只有两种元素,而短周期为前三周期,故甲、乙、丙所在周期为第二周期,戊元素原子半径最小,故为第三周期第ⅦA族,即氯元素,由此推知甲、乙、丙、丁分别为B、C、N、S。甲、乙、丙、丁、戊五种元素原子最外层电子数分别为3、4、5、6、7,故A错误;核外电子数相同的简单离子,其离子半径随核电荷数的增加而减小,B错误;丁元素为S,含有S的酸有硫酸、亚硫酸、氢硫酸、硫氰酸等,C正确;氮的氢化物有NH3、N2H4,D错误。

 阅读快车系列答案
阅读快车系列答案实验室测定含碘废液中I-的含量以及碘的回收过程如下:
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入10 mL 2 mol·L-1H2SO4,加入几滴二苯胺磺酸钠(用作指示剂),用0.0250 mol·L-1标准K2Cr2O7溶液进行滴定至终点。重复3次,数据记录如下表:
(已知反应:①2Fe3++2I-=2Fe2++I2 ②6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
次数 | 1 | 2 | 3 |
滴定体积(mL) | 19.60 | 19.65 | 19.55 |
Ⅱ.碘的回收
取250 mL含碘废液于烧杯中加入按上述计算所需的Na2S2O3溶液,并将CuSO4饱和溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应(已知:2I-+2Cu2++2S2O32-=2CuI↓+S4O62-)。过滤,得到的沉淀按图1进行操作。检查装置的气密性后,从分液漏斗中逐滴加入浓硝酸(注意滴液的速度)完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液。然后按图2进行粗碘的提纯。
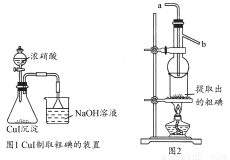
回答下列问题:
(1)用移液管量取废液时,将移液管竖直放入稍倾斜的锥形瓶中,接着的操作是______________________________________,数秒后,取出移液管。
(2)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是__________________________。
(3)根据滴定有关数据,该废液中I-含量是________g·L-1。
在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是_____。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
(4)在图1锥形瓶中发生反应的化学方程式是____________________。
(5)按图2装置进行粗碘提纯,采用的分离方法是________,a、b为冷凝水进出口,其中________(选填a或b)接水龙头进水。最终得到较高纯度的单质碘。