题目内容
【题目】为了验证氯气的氧化性,将氯气分别通入①KI溶液、②H2S溶液、③FeBr2溶液中:
(1)如果要将①中反应后的单质氧化产物从水溶液中分离,需先进行_________(填操作名称),然后进行分液即可;
(2)溶液②中出现淡黄色的沉淀,且反应后溶液呈强酸性,试写出反应的化学方程式__________________________________________________________________;
(3)反应③进行一段时间后振荡,溶液呈黄色,罗同学提出溶液变色的原因可能生成Br2 或Fe3+,请问他该如何通过实验确认生成Br2(限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硝酸银溶液、淀粉—碘化钾溶液)__________________;如果生成的是Fe3+,请写出反应的离子方程式:________________________________;
(4)已知:
Ⅰ.氧化性Cl2>HIO3>Br2>Fe3+>I2
Ⅱ.2Fe3++2I-=2Fe2++I2
将FeBr2、FeI2和HBr(强酸)溶于水,往溶液中通入过量Cl2,各反应或生成的微粒随氯气通入量的变化如下图所示
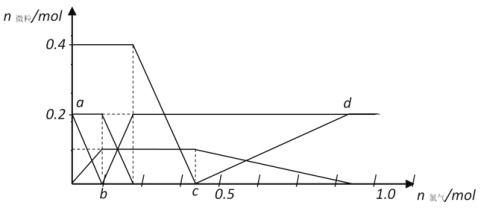
请回答:
①通过实验如何证明ab段反应已开始进行_____________________________;
②c点之前溶液中的阴离子总物质的量最大时为____________mol;
③cd段发生反应的化学方程式为_________________________________。
【答案】萃取 Cl2+H2S=S↓+2HCl 加入CCl4并振荡,溶液分层且下层为橙(黄)色,说明是Br2 2Fe2++Cl2=2Fe3++2Cl- 滴入淀粉试液,如果溶液变蓝说明反应开始 0.8 5Cl2+I2+6H2O=10HCl+2HIO3
【解析】
(1)根据单质碘易溶在有机溶剂中分析;
(2)氯气与硫化氢反应生成单质硫和氯化氢,据此书写;
(3)根据单质溴易溶在有机溶剂中分析,氯气与亚铁离子反应生成铁离子和氯离子,据此解答;
(4)根据氧化性顺序可知通入氯气后,碘离子先被氧化,其次是亚铁离子,然后是溴离子,最后氧化单质碘,结合图像分析解答。
(1)氯气与KI反应生成单质碘,单质碘易溶在有机溶剂中,因此如果要将①中反应后的单质氧化产物从水溶液中分离,需先进行萃取,然后进行分液即可;
(2)溶液②中出现淡黄色的沉淀,且反应后溶液呈强酸性,说明反应后有单质硫和氯化氢生成,则该反应的化学方程式为Cl2+H2S=S↓+2HCl;
(3)由于溴易溶在有机溶剂中,因此确认生成Br2的实验方案是加入CCl4并振荡,溶液分层且下层为橙(黄)色,说明是Br2;氯气能把亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)①根据氧化性顺序可知通入氯气后首先把碘离子氧化为单质碘,由于碘遇淀粉显蓝色,则证明ab段反应已开始进行的实验操作是滴入淀粉试液,如果溶液变蓝说明反应开始;
②通入氯气后,碘离子先被氧化,其次是亚铁离子,然后是溴离子,最后氧化单质碘,根据图像可知c点时溶液中的溴离子恰好全部被氧化,原溶液中碘离子、亚铁离子均是0.2mol、溴离子是0.4mol,反应后生成氯化氢和氯化铁,消耗氯气的物质的量是0.1mol+0.1mol+0.2mol=0.4mol,因此c点之前溶液中阴离子总物质的量最大时为0.4×2=0.8mol;
③根据图像可知cd段发生氯气氧化单质碘的反应,则反应的化学方程式为5Cl2+I2+6H2O=10HCl+2HIO3。