题目内容
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
A. 该合金中铜与镁的物质的量之比是1∶2
B. 该浓硝酸中HNO3的物质的量浓度是13.0 mol/L
C. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
【答案】D
【解析】A、![]() 、
、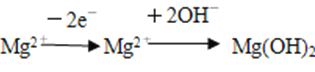 ,加入氢氧化钠溶液,得到沉淀是Cu(OH)2和Mg(OH)2,沉淀的质量是合金的质量与OH-的质量和,即1.52+m(OH-)=2.54,m(OH-)=1.02g,合0.06mol,根据转化关系,失去电子物质的量等于得到OH-物质的量,即合金失去电子物质的量0.06mol,因此有64n(Cu)+24n(Mg)=1.52,2n(Cu)+2n(Mg)=0.06,n(Cu)=0.02mol,n(Mg)=0.01mol,因此合金中铜与镁物质的量之比为2:1,故A错误;B、根据c=1000ρw%/M=1000×1.4×63%/63mol·L-1=14.0mol·L-1,故B错误;C、根据得失电子数目守恒,得出:n(NO2)×1+n(N2O4)×2×1=0.06,n(NO2)+n(N2O4)=1120×10-3/22.4,解得n(NO2)=0.04mol,n(N2O4)=0.01mol,当金属阳离子全部转化成沉淀时,溶质为NaNO3,根据元素守恒,n(NaOH)=n(NaNO3)=(50×10-3×14-0.04-0.01×2)mol=0.64mol,即消耗氢氧化钠的体积为640mL,故C错误;D、根据选项C的分析,NO2的体积分数为0.04/0.05×100%=80%,故D正确。
,加入氢氧化钠溶液,得到沉淀是Cu(OH)2和Mg(OH)2,沉淀的质量是合金的质量与OH-的质量和,即1.52+m(OH-)=2.54,m(OH-)=1.02g,合0.06mol,根据转化关系,失去电子物质的量等于得到OH-物质的量,即合金失去电子物质的量0.06mol,因此有64n(Cu)+24n(Mg)=1.52,2n(Cu)+2n(Mg)=0.06,n(Cu)=0.02mol,n(Mg)=0.01mol,因此合金中铜与镁物质的量之比为2:1,故A错误;B、根据c=1000ρw%/M=1000×1.4×63%/63mol·L-1=14.0mol·L-1,故B错误;C、根据得失电子数目守恒,得出:n(NO2)×1+n(N2O4)×2×1=0.06,n(NO2)+n(N2O4)=1120×10-3/22.4,解得n(NO2)=0.04mol,n(N2O4)=0.01mol,当金属阳离子全部转化成沉淀时,溶质为NaNO3,根据元素守恒,n(NaOH)=n(NaNO3)=(50×10-3×14-0.04-0.01×2)mol=0.64mol,即消耗氢氧化钠的体积为640mL,故C错误;D、根据选项C的分析,NO2的体积分数为0.04/0.05×100%=80%,故D正确。

【题目】甲醇是重要的化工原料,在化工生产中有广泛的应用.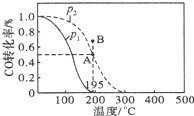
已知反应:CO(g)+2H2(g)CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2 , 测得CO的转化率随温度及压强的变化如下图所示,P2及195℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
(1)0~3min,平均速率V(CH3OH)= , Q0(填“<”“=”或“>”).
(2)图中压强(P1、P2)的大小顺序为 , 理由是 .
(3)在P2及195℃时,该反应的平衡常数K= .