题目内容
【题目】甲醇是重要的化工原料,在化工生产中有广泛的应用.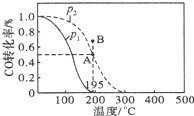
已知反应:CO(g)+2H2(g)CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2 , 测得CO的转化率随温度及压强的变化如下图所示,P2及195℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
(1)0~3min,平均速率V(CH3OH)= , Q0(填“<”“=”或“>”).
(2)图中压强(P1、P2)的大小顺序为 , 理由是 .
(3)在P2及195℃时,该反应的平衡常数K= .
【答案】
(1)0.033mo1?L﹣1?min﹣1;<
(2)P1<P2;相同温度下,增大压强CO转化率提高
(3)25
【解析】解:(1)由表中数据可知,3min内参加反应氢气为8mol﹣4mol=4mol,故v(H2)= ![]() =
= ![]() mol/(L.min),速率之比等于其化学计量数之比,则v(CH3OH)=
mol/(L.min),速率之比等于其化学计量数之比,则v(CH3OH)= ![]() v(H2)=
v(H2)= ![]() ×
× ![]() mol/(Lmin)=0.033mol/(Lmin);由图可知,随温度升高,CO的转化率降低,说明升高温度,平衡向逆反应方向移动,则正反应为放热反应,即Q<0,所以答案是:0.033mol/(Lmin);<;(2)由图可知,相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高,故压强P1<P2 , 所以答案是:P1<P2;相同温度下,增大压强CO转化率提高;(3)在20L的密闭容器中,按物质的量之比1:2充入CO和H2 , 开始氢气的浓度为:
mol/(Lmin)=0.033mol/(Lmin);由图可知,随温度升高,CO的转化率降低,说明升高温度,平衡向逆反应方向移动,则正反应为放热反应,即Q<0,所以答案是:0.033mol/(Lmin);<;(2)由图可知,相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高,故压强P1<P2 , 所以答案是:P1<P2;相同温度下,增大压强CO转化率提高;(3)在20L的密闭容器中,按物质的量之比1:2充入CO和H2 , 开始氢气的浓度为: ![]() =0.4mol/L,CO浓度为:
=0.4mol/L,CO浓度为: ![]() =0.2mol/L,由表中数据可知,3min到达平衡,平衡时氢气浓度为:
=0.2mol/L,由表中数据可知,3min到达平衡,平衡时氢气浓度为: ![]() =0.2mol/L,则: CO(g)+2H2(g)CH3OH(g)
=0.2mol/L,则: CO(g)+2H2(g)CH3OH(g)
开始(mol/L):0.2 0.4 0
转化(mol/L):0.1 0.2 0.1
平衡(mol/L):0.1 0.2 0.1
故平衡常数K= ![]() =25,
=25,
所以答案是:25.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案【题目】根据所学知识完成题目:
(1)某学生用0.20molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
a.以上步骤有错误的是(填编号)
b.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)
c.下图是某次滴定时的滴定管中的液面,其读数为 mL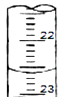
d.根据下列数据:请计算待测盐酸溶液的浓度: mol/L
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
(2)按要求回答下列问题:
a.某温度时,水的离子积常数KW=10﹣13 , 将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b=
b.已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10﹣10 , Ksp(AgY)=1.0×10﹣12 , Ksp(AgZ)=8.7×10﹣17 . 则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y﹣)(填“增大”“减小”或“不变”).
【题目】对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10﹣5 |
H2CO3 | K1=4.3×10﹣7 K2=5.61×10﹣11 |
H3PO4 | K1=7.52×10﹣3 K2=6.23×10﹣8 K3=2.20×10﹣13 |
回答下列问题:
(1)从电离的角度,HCO ![]() 、HPO
、HPO ![]() 、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH= .