题目内容
对于可逆反应: ,在某密闭容器中达到化学平衡状态后,再往此容器中通入
,在某密闭容器中达到化学平衡状态后,再往此容器中通入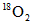 ,较长时间后,下列有关说法中正确的是
,较长时间后,下列有关说法中正确的是
 ,在某密闭容器中达到化学平衡状态后,再往此容器中通入
,在某密闭容器中达到化学平衡状态后,再往此容器中通入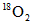 ,较长时间后,下列有关说法中正确的是
,较长时间后,下列有关说法中正确的是[ ]
A.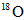 原子只存在氧气中
原子只存在氧气中
B.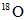 原子只存在三氧化硫中
原子只存在三氧化硫中
C.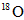 一定不存在二氧化硫中
一定不存在二氧化硫中
D.氧气,二氧化硫,三氧化硫中都可能存在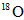
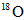 原子只存在氧气中
原子只存在氧气中B.
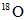 原子只存在三氧化硫中
原子只存在三氧化硫中C.
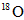 一定不存在二氧化硫中
一定不存在二氧化硫中D.氧气,二氧化硫,三氧化硫中都可能存在
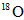
D

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.