题目内容
【题目】工业生产中产生的废气、废液、废渣直接排放会造成污染,很多都经过吸收转化为化工产品。
I.利用电化学原理吸收工业生产中产生的SO2、NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如图(Ce为铈元素)。

请回答下列问题:
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式: 。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示:
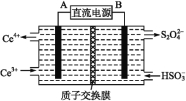
右侧反应室中发生的主要电极反应式为 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4 mol·L-1,要使1 m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为 L。
II.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()
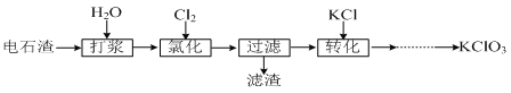
(4)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(5)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。滤渣的主要成分为 (填化学式)。
(6)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL1,从该溶液中尽可能多地析出KClO3固体的方法是 。

(7)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 。
【答案】
(1)NO+Ce4++H2O=NO2-+Ce3++2H+ ;
(2)2HSO3-+2H++2e-=S2O42-+2H2O
(3)4.48×103;(4)AB;
(5)CaCO3、Ca(OH)2;
(6)蒸发浓缩、冷却结晶
(7)Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g)△H=-418kJ/mol
【解析】
试题分析:I.装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2++2H++2NH3=2NH4++2NO3-。
(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(3)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:![]() ×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480;
×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480;
II.电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3。
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解的做法不可取,因浓度过低,对后续实验不利,故答案为:AB;
(5)发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶,则滤渣中含有CaCO3、Ca(OH)2,故答案为:CaCO3、Ca(OH)2;
(6)该溶液中尽可能多地析出KClO3固体,应经蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(7)已知25℃,101kPa时:①CaO(s)+H2SO4(l)═CaSO4(s)+H2O(l)△H=-271kJ/mol,②5CaO(s)+3H3PO4(l)+HF(g)═Ca5(PO4)3F(s)+5H2O(l)△H=-937kJ/mol,根据盖斯定律:①×5-②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F(s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol。

【题目】4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
回答下列问题:
(1)元素x在周期表中的位置是 ,其单质可采用电解熔融 的方法制备。
(2)气体分子(mn)2的电子式为 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极: ,负极: 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式 。
